氨酰tRNA合成酶(aaRSs)是一類與神經退行性類疾病CharcotMarie-Tooth(CMT)相關的蛋白家族。顯性突變導致了疾病的發生,對導致CMT疾病發生的突變的甘氨酸-tRNA合成酶(GlyRS)和酪氨酸-tRNA合成酶(TyrRS)的研究表明,突變使得蛋白產生與功能增強機制相一致的新的結構。與此相反,通過單倍體酵母模型發現組氨酰-tRNA合成酶(HisRS)氨酰化功能的喪失與CMT疾病的發生相關。然而,沒有任何關于導致CMT疾病發生的以往報道是在真實病人來源的細胞樣本中證明tRNAs的氨酰化狀態。通過臨床病人來源的細胞中檢測氨酰化水平,本文研究了與HisRS相關的具有嚴重表型的CMT疾病家族。令人吃驚的是,在正常家庭成員和患病家庭成員之間,組氨酸結合型tRNA水平并沒有差異。并進一步確認,重組的4個促進CMT發生的突變蛋白在體外活性的喪失和體內表型的嚴重程度間無相關性。確實,其中一個對活性最具影響的突變只與輕微的疾病表型相關。在接下來的研究中,本文通過switchSENCE技術分析方法,證明在蛋白二聚化界面發生突變的HisRSs的開放結構與疾病的嚴重度密切相關。事實上,在極其嚴重的病人群體中,HisRSs的突變導致了最大程度的開放型結構。這些研究數據表明,與HisRS相關的CMT疾病產生于構象變化誘導機制,而不是氨酰化水平的丟失。
CMT疾病是最為常見的外周神經遺傳性病變,患病率約為1/2500。該疾病的特征為進展性的肌無力,肌萎縮以及遠端四肢感覺喪失且具有廣泛的遺傳異質性特征。到目前為止,超過90個基因的突變與疾病的發生相關。然而,大多數基因的致病機制目前仍舊不清楚。涉及CMT疾病的最大基因家族編碼氨酰tRNA合成酶,目前涉及其中的6個家族成員(例如甘氨酰-,酪氨酰-,色氨酰-,組氨酰-,甲硫氨酰-tRNA合成酶),同時表明了解aaRS相關的CMT疾病發生機制的重要性。
aaRS通過催化氨基酸與相應的tRNA結合,促進細胞內mRNA的翻譯,以在核糖體內進行蛋白質的合成。氨酰化通過兩步實現。第一步,aaRS結合氨基酸和腺苷 5'-三磷酸(ATP),催化形成一種與酶結合的氨酰-腺苷酸酯,反應過程釋放焦磷酸鹽(PPi);第二步,激活后的氨基酸與tRNA反應,產生氨酰-tRNA。
組氨酰-tRNA合成酶,是與CMT疾病相關的6種aaRSs中的一種,被歸類為 CMT2W 亞型,其主要表現為軸索型癥狀,并且為常染色體顯性遺傳。根據新的CMT疾病分類標準,該亞型也被稱為AD-CMTaxHARS。人類的HisRS蛋白由三個不同的結構域組成:N-端的WHEP結構域,催化結構域和C端反密碼子結合域(請見Fig. 1A)。有趣的是,與CMT疾病相關的HisRS突變位于催化位點附近的催化結構域(請見Fig. 1)。
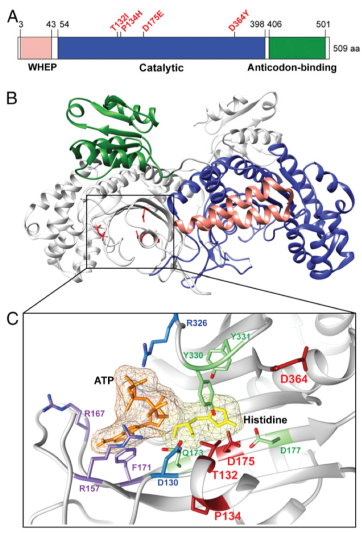
人類tRNA合成酶結構
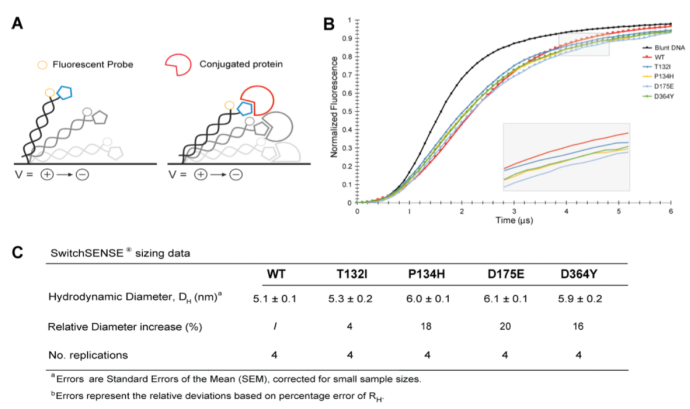
最初發現了4種CMT2W家族,每一種都與一個特定的突變相關聯(例如T132I, P134H, D175E, D364Y),且都具有強有力的遺傳學證據支持這一關聯。相對來說,家族中攜帶P134H突變的病人表現出最為嚴重和長期的癥狀,開始于兒童期或青少年晚期。攜帶D364Y突變的病人表現相對嚴重(盡管這種突變的表型并不完全一致)。攜帶一個T132I或D175E突變的病人或者是受到輕微的影響或有多樣的疾病表現。疾病的嚴重程度通過不同的臨床因素聯合進行評估,包括攜帶突變的病人患病的起始平均年齡以及癥狀的嚴重程度。為了理解在細胞內,這些突變對tRNA氨酰化水平的影響,已有報道在單倍體酵母中進行了遺傳互補實驗以評估蛋白的功能活性。由于4個突變中有3個突變(T132I, P134H, and D364Y)在單倍體酵母模型中導致了蛋白功能的完全喪失,而D175E HisRS保留部分活性,這些結果無法將疾病的嚴重程度與蛋白活性相關聯。其它2種與aaRS相關聯的CMT疾病亞型-CMT2D和DI-CMTC(分別與甘氨酰-tRNA和酪氨酰-tRNA合成酶相關),具有明顯的毒性功能獲得性機制。在分子結構水平上,功能的獲得與突變誘導的更加開放的構象相關,該構象暴露了新的分子表面,可以和大量的蛋白發生相互作用。此外,通過單倍體細胞進行的酵母互補測定法,并不能直接的完全模擬具有二倍體的人類細胞的情況。考慮到與CMT疾病關聯的aaRS突變的顯性特征以及病人中tRNA合成酶野生型等位基因的存在,需要通過病人樣本檢測蛋白活性,以更準確的理解顯性突變對tRNA氨酰化的影響。在本文中,我們獲得了受P134H突變影響最嚴重的病人家族樣本,并通過多種方式對樣本進行分析,包括Northern blot實驗,以檢測內源性的tRNA乙酰化狀態。在P134H突變的病人以及野生型的成員之間,組氨酸tRNA的氨酰化和其他tRNAS的氨酰化,未呈現出結果上的差異。進一步分析純化的重組HisRS和4種導致疾病發生的突變HisRS,確認了酶活性和疾病嚴重程度之間無相關性。與此相反,利用switchSENCE技術檢測蛋白流體動力學大小變化,結果顯示,與其它突變蛋白相比,HisRS P134H突變能夠誘導最大程度的構象變化和結構的開放狀態,并且開放的構象與CMT疾病的病情緊密相關。
驗證HisRS攜帶P134H突變的
CMT病患樣本的tRNA氨酰化情況
酵母互補實驗中,HisRS P134H完全無法支持細胞的生長,表明突變蛋白缺乏將tRNA與組氨酸結合的酶活性。為了在P134H的病人樣本中更進一步理解是否野生型HARS等位基因能夠提供足夠的酶活性以代償等位基因突變造成的功能喪失,我們分析了CMT2W病人家族中的HisRS酶活性。首先比較了來自于2例P134H病人和2例沒有攜帶突變的正常家族的永生的淋巴細胞中的HisRS蛋白水平,未發現差異(請見Fig. 2A),表明突變未影響HisRS的表達和穩定性。為了評估HisRS的酶活性,我們通過Northern blot檢測在這些樣本中,內源性tRNAs的原位氨酰化狀態。提取樣本總RNAs并于酸性條件下進行凝膠電泳,以維持tRNAs的酰化狀態。細胞中,同源胞質型 tRNA 的帶電部分(結合組氨酸)占比約為 50%,該水平在病人和健康的家族樣本中是一致的(Fig. 2B)。做為對照,我們鑒定了非同源的細胞質tRNA(tRNAAIa)和線粒體tRNA的His水平,同樣未發現差異(請見Fig. 2B)。接下來,為了確認病人樣本中酶活性喪失的情況,我們使用細胞裂解液進行了體外氨酰化檢測,比較了蛋白將tRNA氨酰化的能力。我們發現在2例CMT樣本和對照樣本中,氨酰化酶活性并未降低(請見Fig. 2C)。明顯的是,與野生型HisRS相比,P134H突變的HisRS未產生(顯性)負效應,以減弱細胞中tRNA的氨酰化的能力。因此,我們推斷在大多數嚴重的病人細胞中,tRNA攜帶His的水平未受到影響。
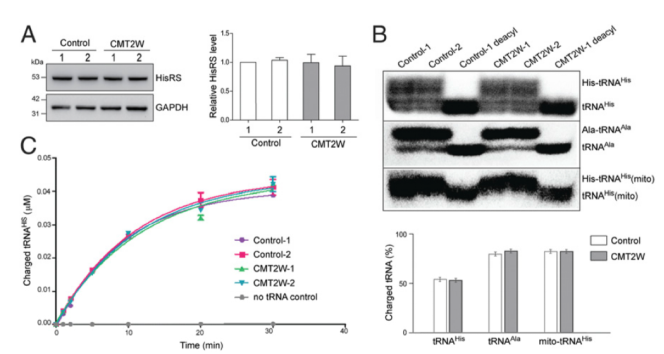
細胞內tRNA氨酰化水平檢測
CMT2W突變的酶活性和疾病的
病情間無相關性
目前未有證據支持在大多數嚴重的CMT2W病人中,氨酰化水平的明顯缺失是源于功能喪失的機制。這使得我們進一步通過體外氨酰化檢測,比較HisRS P134H的氨酰化和表現為輕微表型的CMT2W相關的突變樣本的氨酰化。過表達并純化人的重組野生型HisRS蛋白和4例CMT2W突變型蛋白,以用于精確的檢測分析。有趣的是,與酵母中完全的功能喪失表型相比,HisRS P134H具有很強的活性,氨酰化是野生型的40%,而HisRS D364Y具有完全的氨酰化酶活性。與酵母中檢測結果一致,HisRS T132I功能完全喪失,HisRS D175E具有部分酶活性,略低于HisRS P134H的活性。已得知T132I突變導致了最嚴重的氨酰化功能喪失,但是誘導了相對輕微的表型,沒有證據證明酶活性和疾病的嚴重程度之間存在相關性。最近相繼報道了和CMT2W相關聯的其他突變(例如V155G,Y330C,S356N)并檢測了它們對酶活性動力學的影響。3個已報道的突變在結合底物的能力上均有缺失,尤其是和ATP以及組氨酸結合的能力。為了檢測這種結合的缺失是否在上述四種突變中存在,我們通過ATP/PPi交換檢測實驗對結合動力學進行分析,檢測2步氨酰化反應中的第一步。在該檢測中,HisRS T132I完全喪失了功能,無法進行動力學分析。其他突變(HisRSP134H , HisRSD175E和HisRSD364Y)在不同程度上,與組氨酸和ATP結合的米氏常數(Km)均有增加(請見Fig. 3B),表明突變體在底物結合能力上的缺失,與其他3個CMT2W突變體的結果相一致。然而,由于tRNA氨酰化的第一步并不是限速步驟,與組氨酸和ATP結合能力的輕微缺失并不影響總體的氨酰化反應。與tRNA氨酰化檢測類似(請見Fig. 3A), HisRS D364Y在ATP/PPi交換檢測實驗中表現出最小程度的活性缺失(請見Fig. 3B)。從實驗數據中得到的酶活性強弱順序為T132I > D175E > P134H > D364Y,與疾病嚴重程度并無相關性。
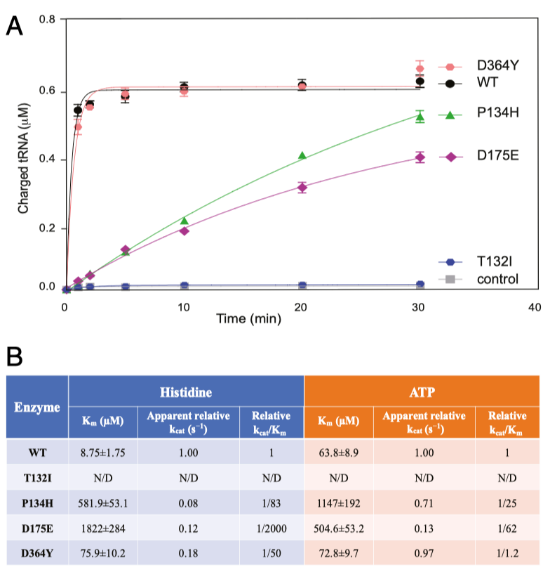
氨酰tRNA合成酶酶與底物結合動力學檢測
HisRS D175E的晶體結構分析表明
在酶活性位點未發生構象改變
突變蛋白Km的增加表明活性位點結構改變的潛在可能性。我們對CMT2W的晶體結構進行了分析。我們獲得了3種突變體的晶體結構,分別是HisRST132I , HisRSD175E和HisRSD364Y。 然而,僅HisRS D175E獲得了高分辨的晶體結構 (3.1 ?)。我們利用野生型的結構做為模版,通過分子代替解析突變體的晶體結構。
有趣的是,HisRS D175E 的晶體結構與 HisRS WT 的結構非常相似,其 376 個 Cα 原子的均方根偏差為0.97 ?。用于突變體的結晶條件和用于野生型蛋白的結晶條件幾乎相同。在ATP-或組氨酸結合點我們未觀測到明顯的差異,和我們從動力學數據得到的預期相一致(請見Fig. 4)。我們將構象變化的缺失歸因于晶格引起的限制,正如我們在其他CMT疾病相關的tRNA合成酶突變中觀測到的,我們進而分析蛋白在溶液中的結構特點。
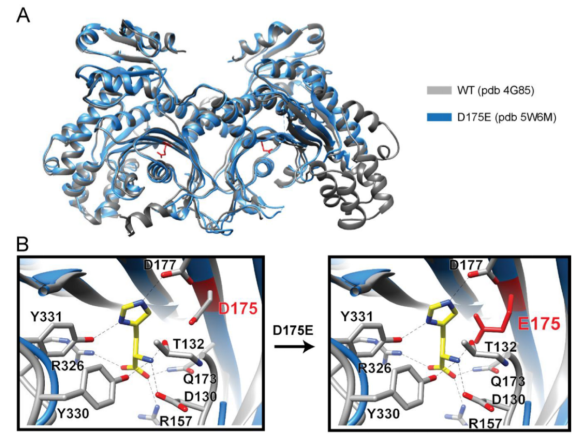
組氨酰tRNA合成酶野生型及突變型晶體結構分析
switchSENCE技術證實CMT2W蛋白
突變對蛋白大小的影響
為了證實觀測到的所有4種CMT突變能夠誘導蛋白形成疏松結構,我們利用switchSENCE技術評估這些蛋白的流體動力學半徑。短的雙鏈DNA一端被偶聯在芯片的金屬表面,另一端與待測蛋白進行結合(請見Fig. 4)。交替變換的正負電壓作用于該DNA雙鏈,并通過與DNA雙鏈連接的熒光探針實時記錄蛋白的運動軌跡。一旦HisRS蛋白偶聯到DNA雙鏈,DNA雙鏈的流體動力學摩擦系數受到影響,DNA的運動速率也同樣受到影響。儀器記錄DNA雙鏈的運動情況,通過該運動的變化情況估測蛋白的流體動力學半徑。我們發現所有的突變體,與野生型相比,流體動力學半徑都有不同程度的增加,相對增加程度在4%和20%之間。HisRS T132I的增加是最小的,與野生型相比,僅有4%的增加。HisRSP134H , HisRSD175E 和HisRSD364Y的變化較為相似,分別為18%,20%和16%。
組氨酰tRNA合成酶野生型及突變型晶體結構分析
switchSENCE技術檢測
氨酰tRNA合成酶的構象變化
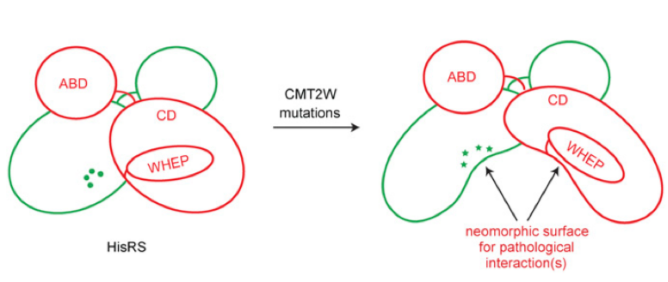
通過測量HisRS突變體的活性,我們可以推斷活性和疾病病情間的相互關聯,同樣,我們也可以推論蛋白構象變化和疾病病情間的相互關聯情況。蛋白由于構象的改變暴露的新的界面可能介導了多種相互作用和毒性功能獲得性效應,導致疾病的發生和發展(請見Fig. 5)。總的來說,本研究提供了一種在CMT患者細胞中研究tRNA合成酶的方法。本研究將疾病的表型和蛋白結構的改變進行了關聯分析,為將來的分子機制研究打開了一種新的思路。
蛋白構象改變誘導新相互作用界面產生的示意圖




