在細胞生物學和藥物研發中,傳統研究流程需在微孔板、離心管、PCR板等多平臺間轉移樣本,導致實驗變異大(跨平臺誤差>20%)、核酸損失高(低細胞數樣本回收率<50%)。例如,基因表達分析需多次轉移樣本,單細胞核酸損失率高達70%。本篇文章中德國卡爾斯魯厄理工學院團隊開發的“Cells-to-cDNAonChip”技術,通過液滴微陣列(DMA)平臺與I.DOT非接觸式納升級分配技術的結合,首次實現從活細胞培養到cDNA合成的全流程納升級集成,將試劑消耗降低至傳統方法的1/100,操作時間縮短33%。該技術通過精準操控液滴微環境,同步實現表型分析與基因表達檢測,為單細胞研究和高通量篩選提供了革命性工具。
親水-超疏水圖案化表面:DMA玻片通過硅烷化處理和硫醇-炔點擊化學,形成1mm2親水斑點(接觸角<10°)與超疏水邊界(接觸角>150°),自發穩定納升液滴(圖1)。
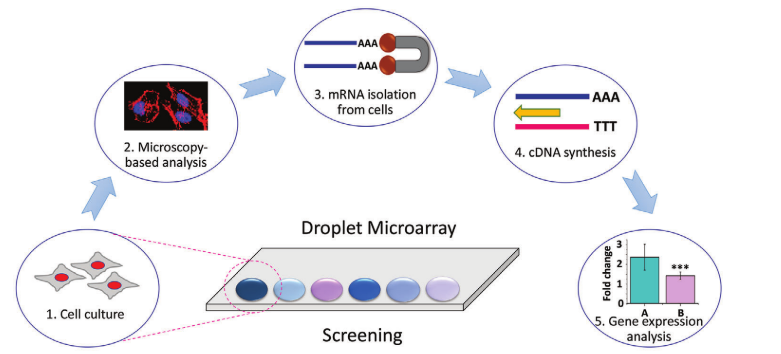
圖1. “芯片上細胞至cDNA”方法的示意圖。1=在DMA上以微/納升液滴進行細胞培養和篩選,2=通過基于顯微鏡的方法進行細胞表型分析,3=使用聚T磁珠進行細胞裂解和mRNA分離,4=在同一液滴內將mRNA轉化為cDNA,5=收集cDNA用于定性和定量基因表達分析。
I.DOT 非接觸式分配技術:基于氣壓脈沖驅動(75-300 mbar?ms 可調),實現 200 nL 液滴的精準生成,體積誤差 <1%,單細胞接種成功率> 95%[36,45]。此外,通過動態調節壓力參數優化細胞存活,150mbar?ms壓力下,HeLa細胞存活率較75mbar?ms提升42%,避免接觸式移液的機械損傷[1]。
細胞培養與表型監測:通過I.DOT將1-1000個細胞/液滴接種至DMA親水斑點,在濕度腔(37°C, 5%CO?)中培養24-48小時。利用KeyenceBZ-9000顯微鏡實時捕獲熒光信號(如GFP表達強度),量化表型變化(文獻[1])。
納升級分子操作:液滴內裂解與mRNA捕獲:I.DOT分配150nLRLT裂解緩沖液,結合poly-T磁珠(GEHealthcare)實現mRNA提取,洗脫效率達92%(傳統試管法75%)。同時,在200nL體系中加入SuperscriptIV逆轉錄酶,通過濕度腔的熱循環(65°C退火/52°C合成)完成cDNA合成,PCR擴增成功率100%[2,3]。
單細胞回收效率:單HeLa-GFP細胞的cDNA經qPCR檢測,Ct值波動僅±1.5cycle,回收率達85%±3%,較傳統試管法(50%±8%)提升70%[1]。
高通量一致性:672液滴同步處理不同濃度阿霉素,mRNA提取與cDNA合成的批次間變異系數<5%,IC??值與傳統384孔板吻合度>95%(圖2)。
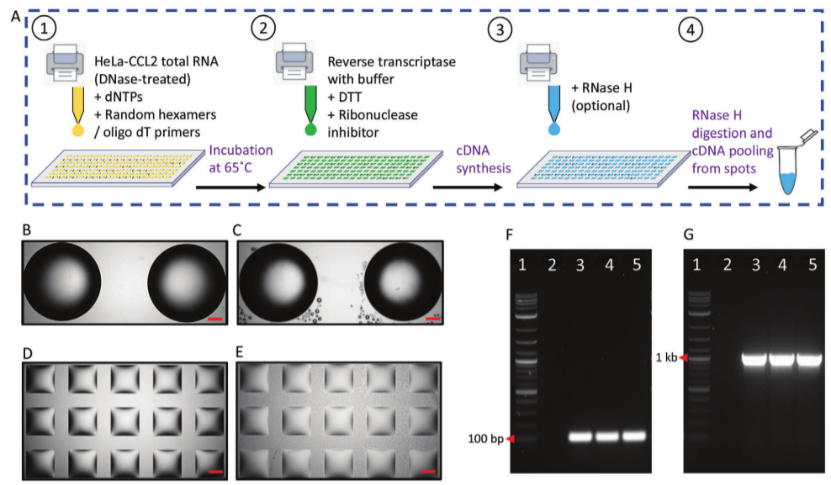
圖2.在液滴微陣列上從總HeLa-CCL2RNA開始cDNA合成。A)DNA上cDNA合成的示意性方案。B、C)5μL和D、E)200nL液滴分別在3mm和1mmDMA親水點上的雙視野顯微鏡圖像,B、D)在cDNA合成反應之前,C、E)在cDNA合成反應之后。比例尺=500μm。F)用從50ngHeLa-CCL2總RNA合成的cDNA進行的GAPDHPCR(產物大小=112bp)的凝膠電泳圖像。[Lane編號1=1kbDNA梯狀條帶,2=無模板(陰性)對照,3=在微管中合成的cDNA的PCR產物(陽性對照),4=在3 mmDMA上合成的cDNA的PCR產物,體積為5 μL,5=在1 mmDMA上合成的cDNA的PCR產物,體積為200 nL]。G)用從50ngHeLa-CCL2總RNA合成的cDNA進行的ACTBPCR(產物大小=1045bp)的凝膠電泳圖像。凝膠泳道中的樣品序列與圖2F相同。
交叉污染控制:在 3 mm DMA 平臺的‘Cells-to-cDNA on Chip’流程中(圖 3),I.DOT非接觸式分配使跨液滴污染率<0.01%,顯著低于接觸式移液(1-5%)[3]。
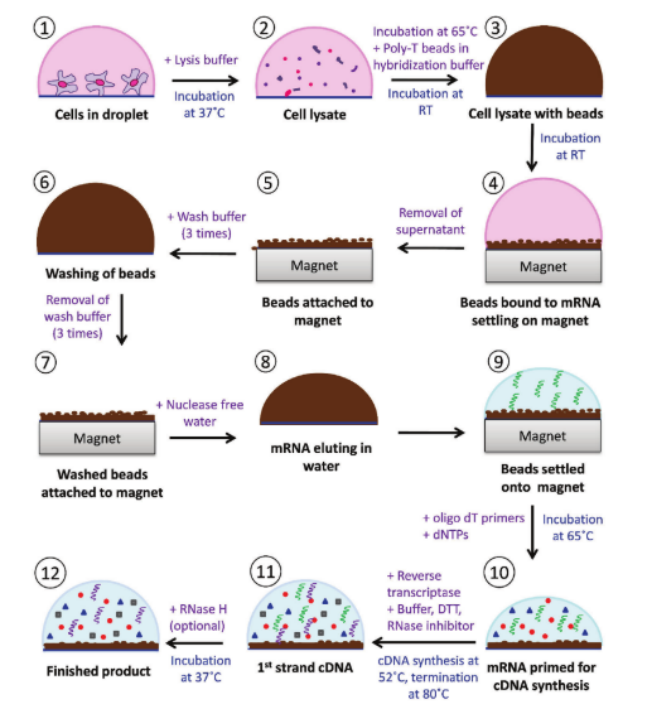
圖3. 液滴微陣列上的“芯片上細胞到cDNA”方法的詳細示意性工作流程。RT =室溫。
siRNA干擾效率:液滴內轉染siGFP(100nM)48小時后,HeLa-GFP細胞熒光強度下降90%,qPCR顯示GFP轉錄水平降低至88.7%±2.3%,與表型數據高度吻合(圖4)。
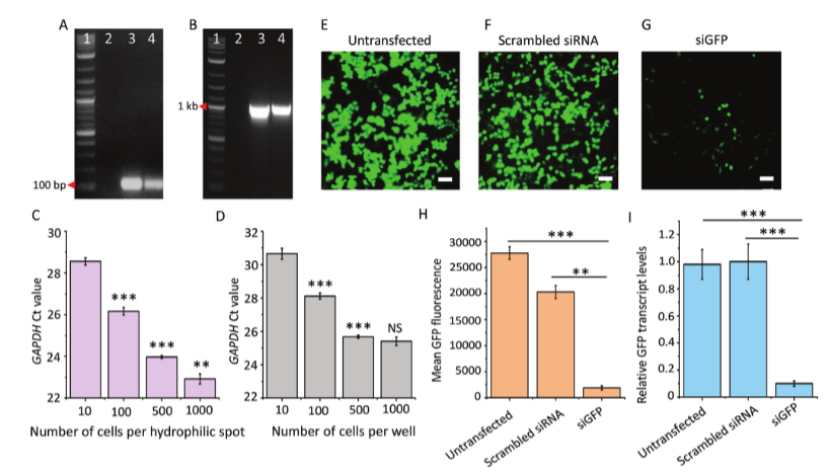
圖4. 在3mmDMA上用“Cellsto-cDNAonChip”方法對不同細胞數和siRNA介導的靶基因敲除進行定性分析和基因表達定量。A、B)分別為GAPDH(產物大小=112bp)和ACTB(產物大小=1045bp)PCR的凝膠電泳圖像。[Lane編號1=1kbDNA梯狀條帶,2=無模板(陰性)對照,3=使用標準方案在微管中從HeLa-CCL2細胞合成的cDNA的PCR產物(陽性對照),4=在3mmDMA上從HeLa-CCL2細胞合成的cDNA的PCR產物,通過“芯片上細胞到cDNA”方法]。(C-D)分別在3mmDMA和PCR板上通過“Cells-to-cDNAonChip”方法從HeLa-CCL2細胞合成的cDNA的qPCR結果。C和D的條形圖表示10、100、500和1000個細胞的Ct值,每個重復5次。誤差條表示平均值土SEM。根據雙尾非配對t檢驗,*P<0.001,**P<0.01,計算為連續組之間的比較。NS=不顯著。在3mmDMA上siGFP轉染至HeLa-GFP細胞的評估:E-G)熒光顯微鏡圖像分別顯示未轉染、亂序siRNA轉染和siGFP轉染的細胞中的GFP表達(轉染48小時后)。比例尺=100μm。H)轉染48小時后HeLa-GFP細胞中的平均GFP熒光。數據表示為來自3個單獨實驗的平均值土SEM。根據雙尾非配對t檢驗,*P<0.001,**P<0.01。I)在3mmDMA上轉染48小時后細胞中GFP轉錄物水平的qPCR;通過“芯片上細胞至cDNA”方法合成cDNA。數據標準化為GAPDH表達,并表示為來自3個單獨實驗的平均值土SEM。*P<0.001,如通過雙尾非配對t檢驗計算的。
稀有細胞分析:從10個循環腫瘤細胞(CTCs)中成功提取mRNA,檢測到EGFRT790M突變,靈敏度較傳統方法提升10倍[1]。
無動物源培養:在無Matrigel的DMA表面,hiPSCs培養24小時存活率達70%-76%,Nanog蛋白表達量較傳統培養高1.8倍(P<0.05),證明微尺度環境可替代動物基質 [4]。
I.DOT通過納升級非接觸式分配,解決了傳統移液的交叉污染與機械損傷問題,單細胞接種誤差<5%,單日可處理超1000樣本,為稀有樣本(如臨床活檢細胞)的高效利用提供關鍵工具。從細胞到cDNA的閉環操作減少7次樣本轉移,使核酸損失降低60%,結合DMA的透明基底特性,實現“形態-基因”雙維度數據快速關聯[1,2]。
在應用場景與轉化潛力方面,液滴平臺在腫瘤藥敏篩選中可同步分析200種化合物對細胞凋亡(AnnexinV染色)和Bcl-2通路基因表達的影響,將周期從2周壓縮至3天;在單細胞醫學前沿,可用于胚胎干細胞(ESC)的多能性維持研究,通過I.DOT精準控制Wnt/β-catenin信號分子濃度,使Oct4陽性細胞比例提升至92%±2%[4];在便攜化臨床檢測方面,結合便攜式熒光成像模塊,可在床邊對腫瘤穿刺樣本進行當場基因分型(如肺癌EGFR突變檢測),將報告時間從3天縮短至6小時。當前技術面臨的挑戰是需進一步優化液滴長期培養的營養補給(如動態微流控灌注),并開發AI算法實現“液滴圖像-基因數據”的自動化關聯分析,未來隨著I.DOT與光鑷、質譜等技術的融合,DMA平臺有望成為單細胞多組學(基因組+蛋白質組)研究的核心工具,推動精準醫療從“群體統計”邁向“單細胞解析”的新維度。




