人體的一系列生理過程依賴于細胞組分與相應分子之間的識別和相互作用。一種生物分子與其他分子之間存在多個結合位點或相互作用的模式,因此,需要能夠精確的鑒定相互作用的空間定位以及結合/解離動力學。在本文中,我們進行了一項三色熒光結合及競爭實驗,可以用于檢測做為轉運和結合蛋白的人血清白蛋白上的三個獨立結合位點的監測和定位。通過獨立的X射線晶體以及時間分辨動力學測試(switchSENSE),確認了該檢測的有效性,包括對結合位點的定位以及揭示了配體結合相關的構象變化。這種分析系統能夠對白蛋白-結合藥物進行詳細的特性分析,因此非常適合用于預測藥物與藥物或藥物與食品之間的相互作用。此外,也能夠實現對結合誘導的構象變化進行分析。
人血清蛋白(HSA)是一種廣泛存在的血漿蛋白質,能夠轉運像脂肪酸一類的疏水性內源配體。它也和多種藥物以及藥物類似物的小分子相互作用。在這種生物分子內,幾個關于配體和HSA復合物的晶體結構揭示了HSA上存在的七個單獨的脂肪酸結合位點。前期,通過引入及應用全新的分子探針NDB-FA,我們分析了與配體結合相關的HSA上結合位點的特異性,在生理條件下,一個白蛋白分子僅可容納0.1-2個脂肪酸分子。與使用過量的自由脂肪酸穩定白蛋白的構象這種標準化晶體化條件相反,我們在接近先前用于測量白蛋白復合物(NBD-FA:HSA 6:1)KD值的條件下獲得了X射線晶體結構(PDB 6ezq,分辨率2.4 ?)。為了更進一步了解白蛋白中結合位點的逐步占據情況以及這些位點和生理學和藥代動力學的相互關系,我們進一步尋求一種快速的光學檢測方法。這種方法在與配體相互作用時,應能夠同時監測不同的白蛋白結合位點。因此,比起當下普遍使用的白蛋白結合檢測方法,它可以提供更多的信息用于理解和優化這些相互作用。
除了以前發表的用7-nitrobenzo-2-oxa-1,3diazole(NBD)標記脂肪酸做為分子探針,需要更多的位點特異性熒光配體作為額外的探針,用于分別標記白蛋白上“Sudlow-site II”布洛芬結合位點和華法林結合位點(Sudlow-site-I)。這些新的標記應與已存在的NBD-FA探針有最小的光譜重疊,以便能夠進行選擇性的光譜檢測和具備相似的結合親和性。它們的結合曲線應展示清晰的平臺期,表明和相應的白蛋白結合位點為特異性結合,此外,必須在Job-plots上展現1:1的結合化學計量比。最后,需要進行關于新鑒定的分子探針和已知的白蛋白位點特異性結合子的競爭性實驗,以明確將這些探針歸類到已知的白蛋白結合位點上。這些新的探針分子應該能夠以濃度依賴的方式釋放已知的熒光配體。
近期,幾篇發表的文獻報道了BODIPY(4,4-difluoro-4-bora-3a,4a-diaza-sindacene)染料的合成和應用,它展現出了和NBD-FA和NBD-標記的配體相似的配體結合時的“開啟”特性。在一些報道中,描述了關于BODIPY衍生物與牛血清白蛋白(BSA)的結合親和性。Er et al.使用來自于Sudlow-site II標記產物庫的一種BODIPY衍生物,發表了兩種熒光染料的混合物用于HSA上雙重藥物靶點鑒定的文章,與布洛芬的競爭性實驗證實了結合位點的特性。非常多的研究促使我們去設計和合成一個靶向Sudlow-site II的BODIPY衍生物5a-c文庫。
首先,我們對這些化合物進行了無偏性的人血清白蛋白結合力測試。具有合適的熒光發射波長,飽和時展示出明確的1:1 HSA:BODIPY化學計量比的化合物進一步用于和布洛芬進行競爭性實驗的研究。BODIPY衍生物5a最后被選為布洛芬的競爭性結合探針。
我們進一步希望使用第三個熒光配體,用于直接標記華法林結合位點 (Sudlow-site I)。華法林衍生物8a完全符合先前提到的標準。此外,它的熒光發射顯著不同于NBD-FA和BODIPY 5a,因此在一種前所未有的三色光檢測中,同步對三種配體進行選擇性的定量應該是可以實現的(請見Figure 1)。
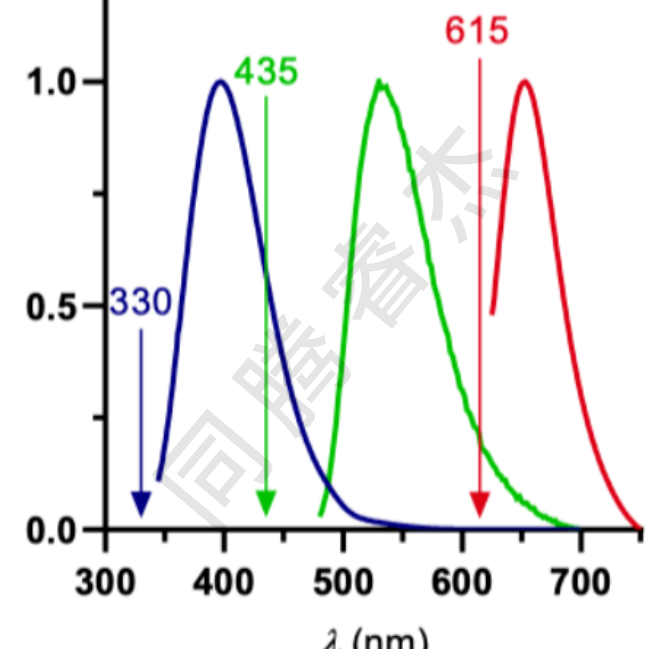
Figure1:華法林衍生物 8a(藍色)、NBD-FA(綠色)和二甲氨基-博迪菲羅 5a(紅色)的吸收光譜(已標準化)
由于我們是通過滴定實驗確定了探針的KD值,我們決定通過不同的方法對這些結果進行獨立的驗證。為此,所有三種配體單獨的特性檢測由switchSENSE技術進行(Dynamic Biosensor,Munich)。這種熒光為基礎的生物傳感器能夠檢測生物分子的生物物理特性,通過熒光接近感應,確定結合和解離(Kon和koff)動力學以及解離常數(KD)。此外,switchSENSE在動力學模式下,通過檢測表面連接的復合物的流體動力學摩擦系數,進而檢測分子內產生的構象變化。本文中,switchSENSE技術不僅通過動力學常數以及結合平衡常數測定KD值,同時能夠用于測量不同化合物和HSA結合后誘導產生的蛋白構象變化。
對于相互作用分析,HSA使用巰基偶聯的化學法將短的,單鏈DNA納米桿固定在金屬芯片的表面。互補的DNA鏈,末端帶有用于信號檢測的熒光染料,通過Au-S鍵共價連到金屬微電極表面。對于HSA和NBD-FA,二甲氨基BODIPY 5a和華法林衍生物 8a的相互作用,測得的KD值在微摩級(NBD-FA: KD = 27.5 μM, BODIPY 5a: KD = 5.2 μM, warfarin derivative 8a: K D = 25.5 μM)(請見Figure 2-5)。
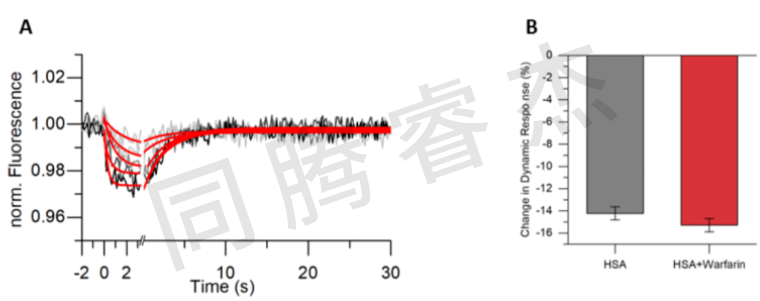
Figure2:A) 利用switchSENSE技術對華法林衍生物 8a 進行動力學研究(接近式傳感,n = 3,每個濃度的數據平均值,5 個濃度分別為 12.5 微摩爾至 200 微摩爾)。B) 在 200 微摩爾 8a 存在的情況下,對 HSA 的相對大小分析顯示其流體動力學直徑沒有變化。
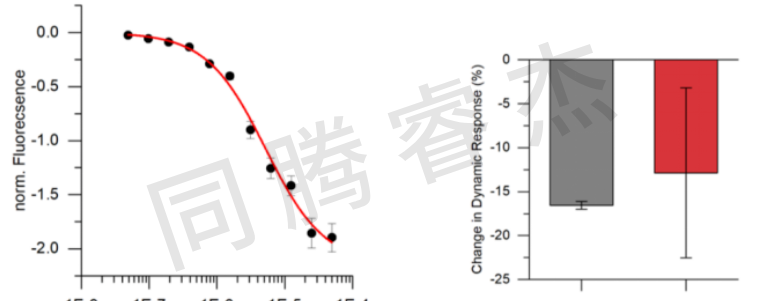
Figure 3:A) 利用switchSENSE技術對 BODIPY 類衍生物 5a 進行的動力學研究。B) 在 400 微摩爾 5a 存在的情況下,人血清白蛋白(HSA)的相對大小分析顯示其流體動力學直徑未發生顯著變化。
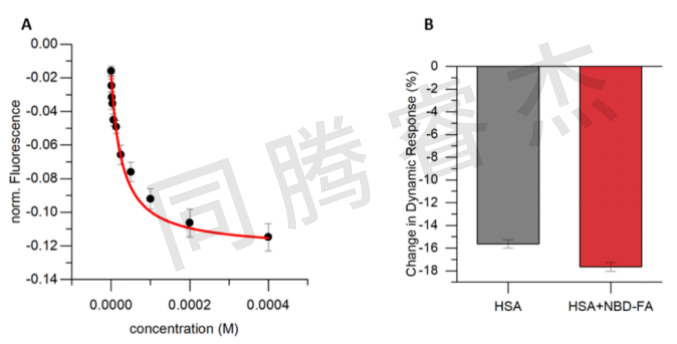
Figure 4:A) 利用switchSENSE技術進行的NBD-FA動力學研究。B) 在400微摩爾NBD-FA存在的情況下,HSA 的相對大小分析顯示其液流直徑有輕微但顯著的擴大。
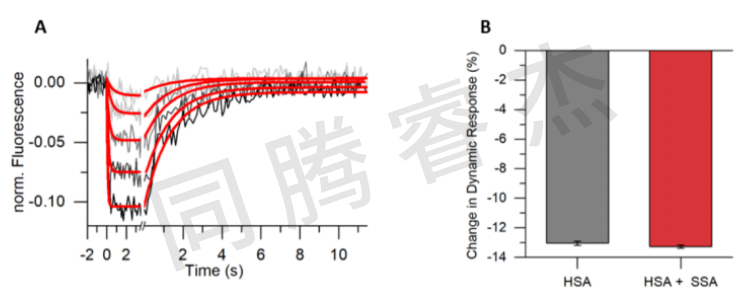
Figure 5:A) 利用switchSENSE技術對柳氮磺胺吡啶進行動力學研究。B) 在 20 微摩爾磺胺吡啶存在的情況下,人血清白蛋白(HSA)的相對大小分析未顯示出流體動力學直徑有顯著變化。
在分子動力學模式,一旦NBD-FA結合,HSA展示了明顯的舒展。由于在溶液中存在較高的流體動力學半徑,HSA的分子動力隨之降低。這種效應在BODIPY 5a和華法林衍生物 8a中都沒有觀測到。令人滿意的是,這三種標簽在所選的組合中表現良好,并且在每種情況下都允許在各自的結合位點上進行選擇性競爭。Figures 6展示了典型的競爭性實驗。在給定的濃度下,商業化的藥物被加入到HSA與三色“雞尾酒”混合液中。布洛芬,酪洛芬和消炎痛選擇性的取代二甲氨基-BODIPY 5a,表明該探針選擇性與白蛋白布洛芬結合位點結合(Sudlow-site II)。除了5a,消炎痛也取代華法林衍生物 8a。對于柳氮磺吡啶,一種用于治療關節炎,潰瘍性結腸炎以及克羅恩氏病的商業化藥物,可使NBD-FA和coumarin 8a的熒光信號減少,表明這兩種探針配體從蛋白上釋放,而BODIPY 5a(Sudlow-site II)沒有釋放。
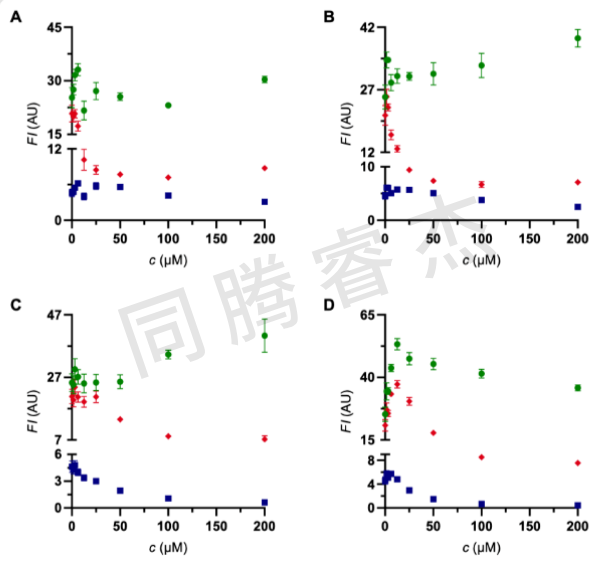
Figure 6:NBD-FA/BODIPY 5a/coumarin 8a (8 μM each) 在HSA蛋白上的競爭性實驗。綠色NBD-FA,紅色BODIPY 5a,藍色warfarin derivative 8a. A) ibuprofen,B) ketoprofen,C) indomethacin,D) iophenoxic acid
本文使用三色“雞尾酒”混合染料,能夠對HSA血清白蛋白的多個藥物結合位點同時進行特異性研究,提高了對藥物與蛋白互作檢測的靈敏度和靈活性;同時,switchSENSE技術能夠在檢測不同的染料與HSA相互作用動力學的同時,也能觀測到HSA的大小變化程度,為藥物的作用機理提供了一種有價值的補充說明。




