體內(nèi)組織的生理功能依賴2D細(xì)胞單層與3D細(xì)胞球體的空間有序互作,但傳統(tǒng)共培養(yǎng)方法(如Transwell、微流控芯片)存在樣本用量大、通量低、難以精準(zhǔn)定位兩種細(xì)胞形態(tài)的痛點(diǎn),阻礙了對細(xì)胞信號傳導(dǎo)、癌癥侵襲等復(fù)雜生物過程的研究[1-3]。droplet microarray(DMA)平臺憑借超微量反應(yīng)特性,結(jié)合I.DOT非接觸式納升級移液技術(shù),為解決這一難題提供了新思路。本研究開發(fā)基于DMA的2D/3D細(xì)胞共培養(yǎng)方法,通過I.DOT精準(zhǔn)控制細(xì)胞打印與液滴融合,實(shí)現(xiàn)14×14陣列的高通量微型化共培養(yǎng),兩種細(xì)胞形態(tài)無物理接觸但可通過旁分泌信號互作,并成功應(yīng)用于Wnt信號傳導(dǎo)研究,為基礎(chǔ)生物學(xué)與藥物篩選提供了實(shí)用且高效的工具。
采用7.5×2.5 cm DMA芯片,含3個14×14陣列(共588個)1mm×1mm親水斑點(diǎn),間距500 μm(超疏水邊界分隔,圖1a)。選取HepG2、HEK293T、HeLa RFP等細(xì)胞,以DMEM為基礎(chǔ)培養(yǎng)基;通過“懸滴法”形成3D球體,2D細(xì)胞直接貼壁培養(yǎng);以Wnt-3a分泌細(xì)胞(HEK293T-Wnt3a)和Wnt報告細(xì)胞(HEK293T-TOP-GFP)驗(yàn)證信號傳導(dǎo)功能。
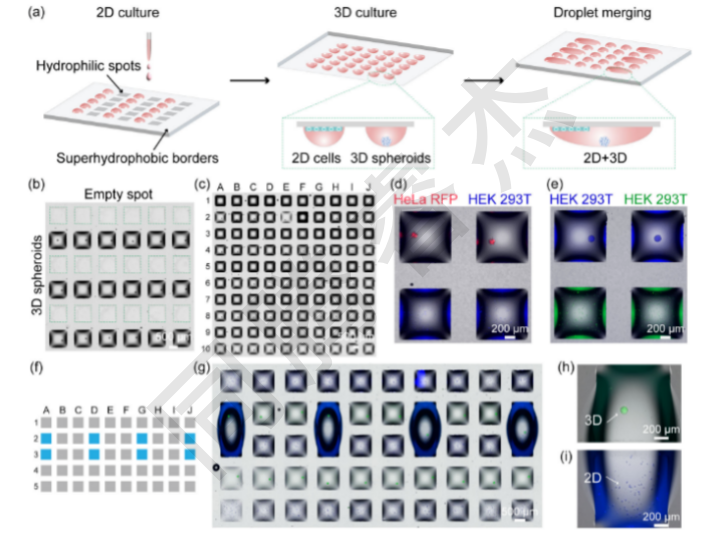
圖1.用于二維和三維(分別為2D和3D)細(xì)胞培養(yǎng)的并行和組合研究的工程平臺。(a)創(chuàng)建2D/3D單元陣列的工作流程示意圖。首先,細(xì)胞被打印在指定的行中,并孵化一夜,以使細(xì)胞形成2D單層。其次,用細(xì)胞懸浮液填充剩余的斑點(diǎn),并以倒置的位置(“懸滴”法)孵育,得到3D細(xì)胞球體。最后,將相鄰的液滴合并,形成2D和3D單元結(jié)構(gòu)。(b)液滴微陣列(DMA)裝置的代表性顯微鏡圖像,該裝置在指定行上包含HEK293T球體。(c)DMA的代表性顯微鏡圖像,其中包含分離液滴中的2D和3D細(xì)胞培養(yǎng)。第1、3、5、7、9行包含2D培養(yǎng)的HepG2細(xì)胞,而第2、4、6、8、10行包含3DHEK293T球體。(d)包含HEK293T細(xì)胞的相鄰液滴的典型熒光圖像,如2D單層(藍(lán)色)和HeLa球體(紅色)。(e)典型的熒光圖像,顯示包含HEK293T細(xì)胞的相鄰液滴為2D單層(綠色)和HEK293T球體(藍(lán)色)。(f)用藍(lán)色標(biāo)記的相鄰斑點(diǎn)合并的DMA示意圖。(g)DMA的顯微鏡圖像,其中合并了包含2D HepG2細(xì)胞和3DHEK293T球體的液滴。在一個合并的液滴中具有代表性的3D球體(H)和2D細(xì)胞(I)的顯微鏡圖像。
2D細(xì)胞單層制備:通過I.DOT非接觸式納升級移液系統(tǒng)將200 nL細(xì)胞懸液(HepG2,7.5×10? cells/mL,約150個細(xì)胞/斑點(diǎn))精準(zhǔn)打印至DMA親水斑點(diǎn),正置放入含濕潤墊的培養(yǎng)皿(37℃、5%CO?),培養(yǎng)24h后細(xì)胞貼壁形成完整2D單層(圖1a;圖2a)。I.DOT的納升級精準(zhǔn)分配確保每個斑點(diǎn)細(xì)胞密度變異系數(shù)<5%,為后續(xù)實(shí)驗(yàn)重復(fù)性奠定基礎(chǔ)。
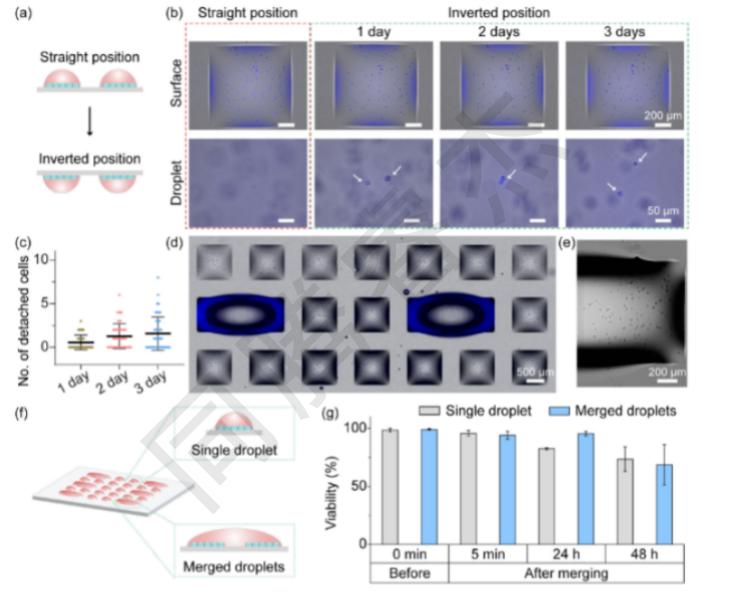
圖2. 在DMA上的合并液滴中進(jìn)行2D單層細(xì)胞培養(yǎng)。(a)直位和倒位培養(yǎng)2D單層細(xì)胞的工作流程示意圖。(b)倒置培養(yǎng)1天、2天和3天后,典型的顯微鏡圖像顯示HepG2細(xì)胞附著在DMA(上圖)上,并在液滴中脫落細(xì)胞(下圖)。白色箭頭顯示液滴中的細(xì)胞,這些細(xì)胞從表面分離。(c)顯示在DMA表面倒置培養(yǎng)細(xì)胞1-3天后從表面脫落的細(xì)胞數(shù)量的曲線圖(n=50)。(d)單層培養(yǎng)中含有單個和合并的含有HepG2細(xì)胞的液滴的DMA顯微鏡圖像。(e)單個親水點(diǎn)的特寫圖像,其中包含單層的HepG2細(xì)胞,作為合并液滴的一部分。(f)含有2D培養(yǎng)細(xì)胞的兩個相鄰液滴合并的工作流程示意圖。(g)在兩個相鄰液滴合并前、合并后5分鐘、24小時和48小時,HeLa細(xì)胞在DMA上的存活率。2D,二維;3D,三維;DMA,液滴微陣列。
3D細(xì)胞球體構(gòu)建:先通過I.DOT向DMA斑點(diǎn)打印100 nL抗黏附溶液(減少細(xì)胞與DMA芯片表面黏附),室溫干燥10min;再打印200 nL的HEK293T懸液(1×10? cells/mL,約200個細(xì)胞/斑點(diǎn)),立即倒置芯片并置于定制3D打印支架上,形成“懸滴”(圖3a);重力驅(qū)動細(xì)胞聚集,培養(yǎng)48h后自發(fā)形成直徑約200 μm的均一3D球體(圖1a;圖3b-c)。
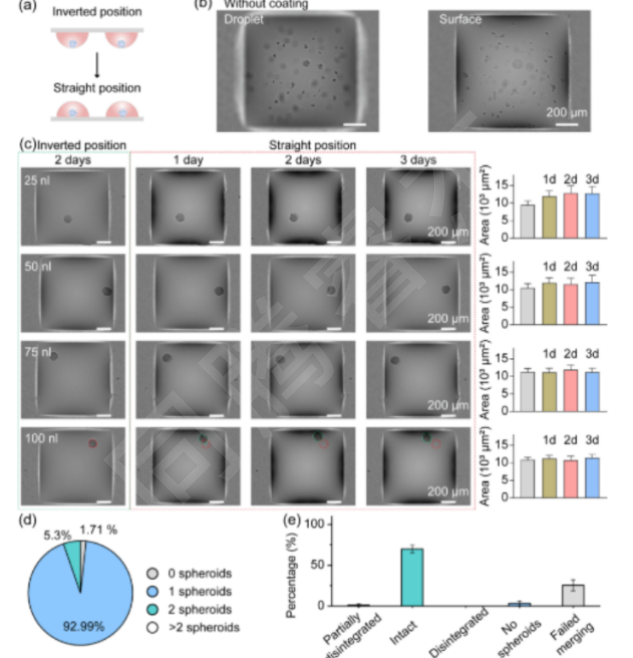
圖3. 在DMA上的合并液滴中進(jìn)行3D球體培養(yǎng)。(a)倒置和直立培養(yǎng)3D球體的工作流程示意圖。(b)HEK293T細(xì)胞在200nL液滴中未涂層斑點(diǎn)形成的細(xì)胞團(tuán)。(c)細(xì)胞接種兩天后,HEK293T細(xì)胞球體在涂有25、50、75和100 nL抗黏附溶液的斑點(diǎn)上形成的典型顯微鏡圖像(左圖)。在DMA上培養(yǎng)的球體的典型顯微鏡圖像(n=42)。第四排的紅色和綠色圓圈分別代表球體的原始位置和當(dāng)前位置,表明即使在直位培養(yǎng)3天后,球體也不會附著在表面。(d)餅圖,顯示每個液滴含有0(不形成球體)、1個、2個和2個以上球體的液滴的百分比。(e)圖表,顯示成功合并的液滴中含有完整、部分解體、解體和沒有球體的液滴的百分比,以及未能合并的液滴的百分比。2D,二維;3D,三維;DMA,液滴微陣列。
液滴融合與共培養(yǎng):通過I.DOT向相鄰的“2D單層斑點(diǎn)”和“3D球體斑點(diǎn)”中各添加900nL新鮮培養(yǎng)基,液滴因體積增加跨越超疏水邊界,融合形成含兩種細(xì)胞形態(tài)的單一液滴(總?cè)莘e約2000nL,圖1a;圖4d-e)。融合后2D細(xì)胞保持貼壁,3D球體懸浮于培養(yǎng)基中,二者無物理接觸,僅通過培養(yǎng)基進(jìn)行旁分泌信號交換。
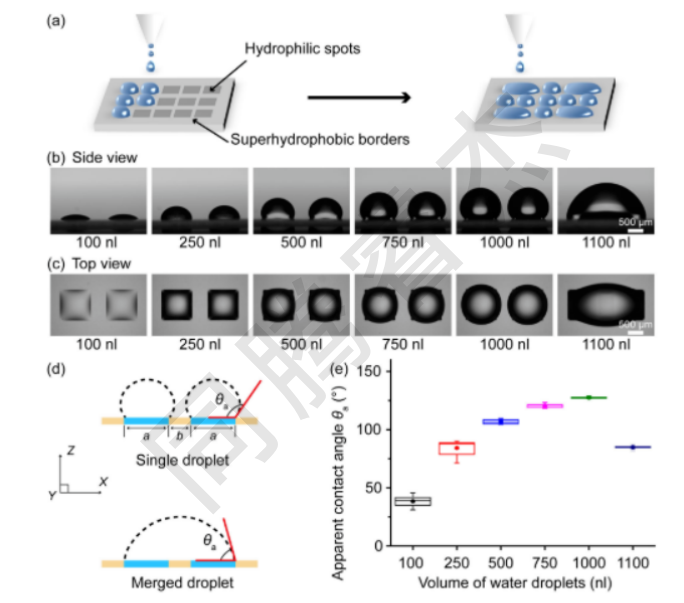
圖4. 控制兩個相鄰液滴的合并。(a)使用I.DOT分配和合并相鄰液滴的示意圖。DMA兩個相鄰親水點(diǎn)上不同體積的水滴的側(cè)視圖。(b)和俯視圖(c),DMA包含1 mm×1 mm的方形親水斑點(diǎn),以及500微米的兩個斑點(diǎn)邊緣之間的超疏水邊界。(d)限制在親水斑點(diǎn)上的單個水滴和合并水滴的示意圖。(e)顯示不同體積的液滴的表觀水接觸角(θa)的曲線圖,范圍從100至1100 nL(n=10)。液滴微陣列。
檢測與分析:通過熒光顯微鏡(Keyence BZ-X800)觀察細(xì)胞形態(tài);Hoechst 33342(總細(xì)胞)與PI(死細(xì)胞)染色評估活力(I.DOT打印50 nL染色液至每個斑點(diǎn),孵育15min);Wnt信號實(shí)驗(yàn)中,通過confocal顯微鏡(Zeiss LSM800)采集GFP熒光圖像,ImageJ量化熒光積分密度(定義為:平均熒光強(qiáng)度×細(xì)胞/球體面積),統(tǒng)計信號激活效率。
1、I.DOT保障
2D/3D細(xì)胞形態(tài)穩(wěn)定性
2D單層完整性:I.DOT打印的HepG2細(xì)胞正置培養(yǎng)24h形成致密單層,即使倒置“懸滴”培養(yǎng)3天,僅1.5±0.3個細(xì)胞/斑點(diǎn)脫落(占總細(xì)胞數(shù)的1%,圖2b-c);液滴融合后,2D單層無破損,細(xì)胞活力維持在94.2%±2.1%(圖2g),證明I.DOT的打印與融合操作對細(xì)胞損傷極小。
3D球體均一性:經(jīng)I.DOT打印100 nL抗黏附溶液后,92.99%的DMA斑點(diǎn)可形成單個3D球體(圖3d),球體圓形度>0.9,直徑變異系數(shù)<8%;正置培養(yǎng)3天內(nèi),球體無貼壁或解體,僅體積輕微增加5.2%(圖3c);液滴融合后,僅0.8%的球體出現(xiàn)破損(圖3e),驗(yàn)證了3D形態(tài)的穩(wěn)定性。
I.DOT打印的200 nL液滴在親水斑點(diǎn)上穩(wěn)定存在(接觸角38°±4°,圖4e),當(dāng)向相鄰斑點(diǎn)添加培養(yǎng)基至總?cè)莘e達(dá)1100 nL時,液滴自發(fā)跨越超疏水邊界融合,形成接觸角85°±1°的穩(wěn)定大液滴(圖4b-e);融合過程耗時僅110s/20組,且24h內(nèi)無蒸發(fā)或滲漏(體積變化<3%),證明I.DOT可通過體積精準(zhǔn)控制實(shí)現(xiàn)高通量液滴融合。
3、Wnt 信號雙向傳導(dǎo):
共培養(yǎng)體系的功能驗(yàn)證
3D→2D信號傳導(dǎo):I.DOT構(gòu)建“Wnt-3a分泌球體(3D)+報告細(xì)胞單層(2D)”共培養(yǎng)模型,融合后72h,報告細(xì)胞GFP熒光積分密度達(dá)297.1±91.0,是無Wnt-3a對照組(35.7±14.5)的8.3倍(圖5b-c),且熒光均勻分布于2D單層,證明信號從3D球體高效傳遞至2D細(xì)胞。
2D→3D信號傳導(dǎo):反向構(gòu)建“Wnt-3a分泌單層(2D)+報告球體(3D)”模型,融合后72h,報告球體GFP熒光積分密度達(dá)605.5±214.8,是對照組(68.2±35.7)的8.9倍(圖5f-g),且球體內(nèi)部細(xì)胞均激活GFP,驗(yàn)證了信號傳導(dǎo)的雙向性與完整性。
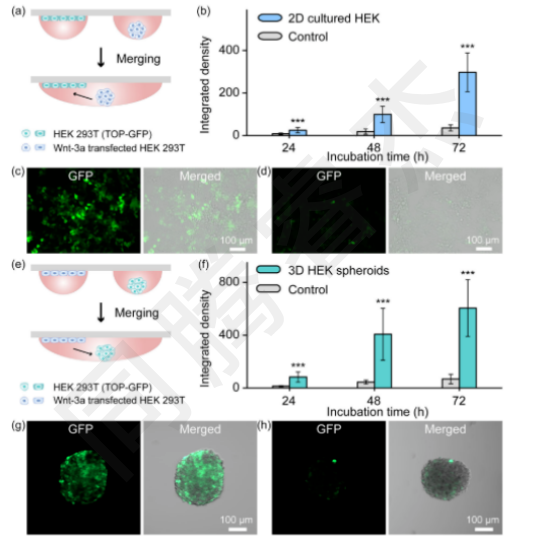
圖5. Wnt-3a在2D/3D細(xì)胞陣列中的旁分泌傳播和Wnt信號的激活。(a)頂端綠色熒光蛋白(GFP)熒光報告細(xì)胞在2D單層中與WNT-3a產(chǎn)生細(xì)胞球體共培養(yǎng)的工作流程示意圖。(b)共培養(yǎng)24、48、72小時后2D報告細(xì)胞積分密度的曲線圖。積分密度定義為平均綠色熒光蛋白熒光強(qiáng)度與細(xì)胞面積的乘積(n=30,*p<;0.001,單因素方差分析)。GFP激活的典型熒光圖像。(c)和對照實(shí)驗(yàn)(不含WNT-3a);(d),(e)WNT-3a產(chǎn)生細(xì)胞在2D單層和TOP-GFP報告細(xì)胞中培養(yǎng)為球體的共培養(yǎng)工作流程示意圖。(f)顯示共培養(yǎng)24、48和72小時后3D報告球體的綜合密度的曲線圖。積分密度定義為平均綠色熒光蛋白熒光強(qiáng)度與球體面積的乘積(n=10,*p<;0.001,單因素方差)。GFP激活的典型熒光圖像。(g)和對照分析(在沒有WNT-3a的情況下)。(h) 2D,二維;3D,三維;DMA,液滴微陣列。
本研究基于DMA平臺開發(fā)的2D/3D細(xì)胞共培養(yǎng)體系,通過I.DOT非接觸式納升級移液技術(shù)實(shí)現(xiàn)了三大核心突破:首先是精準(zhǔn)性革新,I.DOT解決了傳統(tǒng)共培養(yǎng)“細(xì)胞定位難、體積誤差大”的痛點(diǎn),可實(shí)現(xiàn)“200 nL細(xì)胞懸液-100 nL抗黏附溶液-900 nL融合培養(yǎng)基”的均一操作,使2D細(xì)胞單層脫落率<1%、3D細(xì)胞球體單球率>92%,為旁分泌信號研究提供了穩(wěn)定的微型化模型;其次是高通量與功能兼容,單塊DMA芯片含588個獨(dú)立斑點(diǎn),可同步開展數(shù)百組共培養(yǎng)實(shí)驗(yàn)(通量為Transwell的6倍),且體系兼容熒光成像、活力檢測與信號量化,成功解析了Wnt信號在2D與3D細(xì)胞間的雙向傳導(dǎo),填補(bǔ)了“體外模擬體內(nèi)細(xì)胞互作”的技術(shù)空白。
未來,I.DOT不僅可用于細(xì)胞信號傳導(dǎo)研究,還可拓展至癌癥侵襲(腫瘤球體與基質(zhì)細(xì)胞共培養(yǎng))、藥物篩選(評估藥物對2D/3D細(xì)胞互作的影響)、胚胎發(fā)育模擬(多細(xì)胞形態(tài)空間互作)等領(lǐng)域,結(jié)合I.DOT的自動化特性,可實(shí)現(xiàn)共培養(yǎng)實(shí)驗(yàn)的規(guī)模化開展,為基礎(chǔ)生物學(xué)研究與轉(zhuǎn)化醫(yī)學(xué)提供“接近體內(nèi)微環(huán)境”的高效工具;而I.DOT與DMA的協(xié)同,不僅重新定義了2D/3D細(xì)胞共培養(yǎng)的實(shí)現(xiàn)路徑,更推動了“超微量、高通量、功能化”細(xì)胞互作研究的發(fā)展,為解析復(fù)雜生物機(jī)制提供了全新技術(shù)范式。
1、Nsagha, D. S.; Njunda, A. L.; Kamga, H. L. F.; Assob, J. C. N.; Bongkem, E. A. HIV-1/HIV-2 Co-infection among Voluntary Counselling and Testing Subjects at a Regional Hospital in Cameroon. Afr. Health Sci. 2012, 12, 276?281.
2、Wejse, C.; Patsche, C. B.; Kuhle, A.; Bamba, F. J. V.; Mendes, M. S.; Lemvik, G.; Gomes, V. F.; Rudolf, F. Impact of HIV-1, HIV-2, and HIV-1+2 Dual Infection on the Outcome of Tuberculosis. Int. J. Infect. Dis. 2015, 32, 128?134.




