體內組織的生理功能依賴2D細胞單層與3D細胞球體的空間有序互作,但傳統共培養方法(如Transwell、微流控芯片)存在樣本用量大、通量低、難以精準定位兩種細胞形態的痛點,阻礙了對細胞信號傳導、癌癥侵襲等復雜生物過程的研究[1-3]。droplet microarray(DMA)平臺憑借超微量反應特性,結合I.DOT非接觸式納升級移液技術,為解決這一難題提供了新思路。本研究開發基于DMA的2D/3D細胞共培養方法,通過I.DOT精準控制細胞打印與液滴融合,實現14×14陣列的高通量微型化共培養,兩種細胞形態無物理接觸但可通過旁分泌信號互作,并成功應用于Wnt信號傳導研究,為基礎生物學與藥物篩選提供了實用且高效的工具。
采用7.5×2.5 cm DMA芯片,含3個14×14陣列(共588個)1mm×1mm親水斑點,間距500 μm(超疏水邊界分隔,圖1a)。選取HepG2、HEK293T、HeLa RFP等細胞,以DMEM為基礎培養基;通過“懸滴法”形成3D球體,2D細胞直接貼壁培養;以Wnt-3a分泌細胞(HEK293T-Wnt3a)和Wnt報告細胞(HEK293T-TOP-GFP)驗證信號傳導功能。
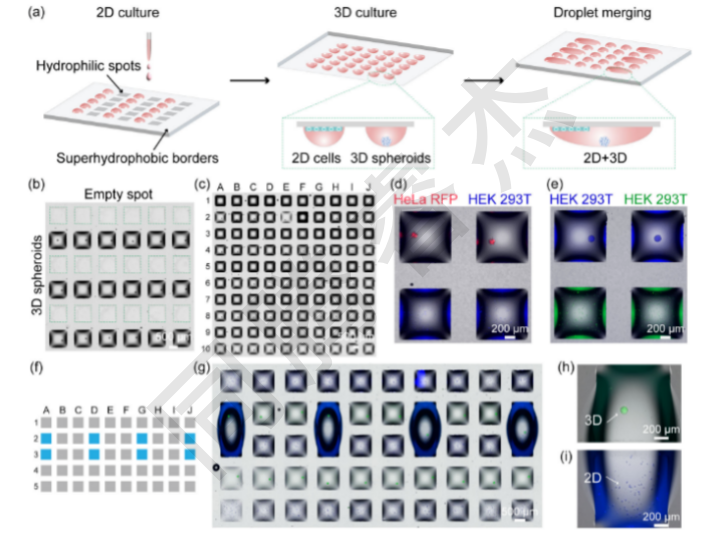
圖1.用于二維和三維(分別為2D和3D)細胞培養的并行和組合研究的工程平臺。(a)創建2D/3D單元陣列的工作流程示意圖。首先,細胞被打印在指定的行中,并孵化一夜,以使細胞形成2D單層。其次,用細胞懸浮液填充剩余的斑點,并以倒置的位置(“懸滴”法)孵育,得到3D細胞球體。最后,將相鄰的液滴合并,形成2D和3D單元結構。(b)液滴微陣列(DMA)裝置的代表性顯微鏡圖像,該裝置在指定行上包含HEK293T球體。(c)DMA的代表性顯微鏡圖像,其中包含分離液滴中的2D和3D細胞培養。第1、3、5、7、9行包含2D培養的HepG2細胞,而第2、4、6、8、10行包含3DHEK293T球體。(d)包含HEK293T細胞的相鄰液滴的典型熒光圖像,如2D單層(藍色)和HeLa球體(紅色)。(e)典型的熒光圖像,顯示包含HEK293T細胞的相鄰液滴為2D單層(綠色)和HEK293T球體(藍色)。(f)用藍色標記的相鄰斑點合并的DMA示意圖。(g)DMA的顯微鏡圖像,其中合并了包含2D HepG2細胞和3DHEK293T球體的液滴。在一個合并的液滴中具有代表性的3D球體(H)和2D細胞(I)的顯微鏡圖像。
2D細胞單層制備:通過I.DOT非接觸式納升級移液系統將200 nL細胞懸液(HepG2,7.5×10? cells/mL,約150個細胞/斑點)精準打印至DMA親水斑點,正置放入含濕潤墊的培養皿(37℃、5%CO?),培養24h后細胞貼壁形成完整2D單層(圖1a;圖2a)。I.DOT的納升級精準分配確保每個斑點細胞密度變異系數<5%,為后續實驗重復性奠定基礎。
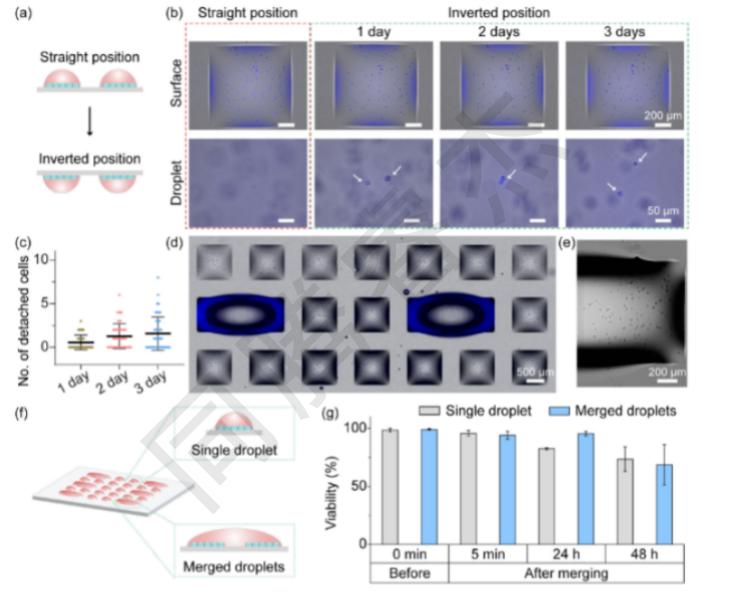
圖2. 在DMA上的合并液滴中進行2D單層細胞培養。(a)直位和倒位培養2D單層細胞的工作流程示意圖。(b)倒置培養1天、2天和3天后,典型的顯微鏡圖像顯示HepG2細胞附著在DMA(上圖)上,并在液滴中脫落細胞(下圖)。白色箭頭顯示液滴中的細胞,這些細胞從表面分離。(c)顯示在DMA表面倒置培養細胞1-3天后從表面脫落的細胞數量的曲線圖(n=50)。(d)單層培養中含有單個和合并的含有HepG2細胞的液滴的DMA顯微鏡圖像。(e)單個親水點的特寫圖像,其中包含單層的HepG2細胞,作為合并液滴的一部分。(f)含有2D培養細胞的兩個相鄰液滴合并的工作流程示意圖。(g)在兩個相鄰液滴合并前、合并后5分鐘、24小時和48小時,HeLa細胞在DMA上的存活率。2D,二維;3D,三維;DMA,液滴微陣列。
3D細胞球體構建:先通過I.DOT向DMA斑點打印100 nL抗黏附溶液(減少細胞與DMA芯片表面黏附),室溫干燥10min;再打印200 nL的HEK293T懸液(1×10? cells/mL,約200個細胞/斑點),立即倒置芯片并置于定制3D打印支架上,形成“懸滴”(圖3a);重力驅動細胞聚集,培養48h后自發形成直徑約200 μm的均一3D球體(圖1a;圖3b-c)。
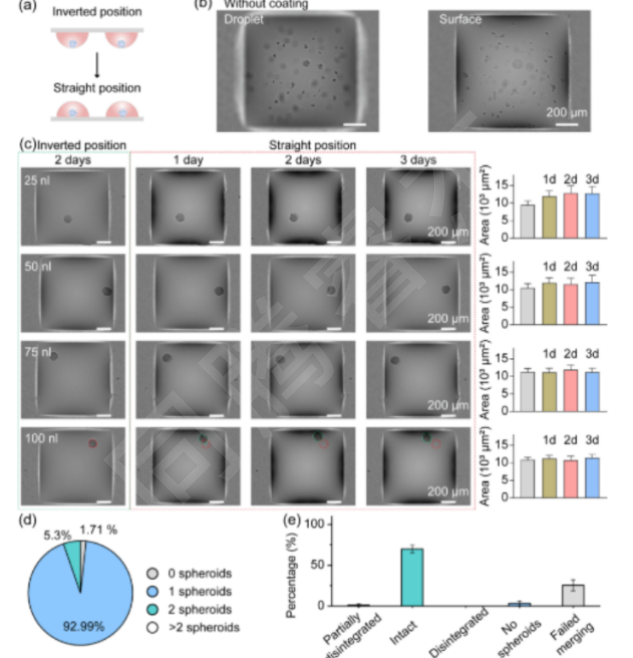
圖3. 在DMA上的合并液滴中進行3D球體培養。(a)倒置和直立培養3D球體的工作流程示意圖。(b)HEK293T細胞在200nL液滴中未涂層斑點形成的細胞團。(c)細胞接種兩天后,HEK293T細胞球體在涂有25、50、75和100 nL抗黏附溶液的斑點上形成的典型顯微鏡圖像(左圖)。在DMA上培養的球體的典型顯微鏡圖像(n=42)。第四排的紅色和綠色圓圈分別代表球體的原始位置和當前位置,表明即使在直位培養3天后,球體也不會附著在表面。(d)餅圖,顯示每個液滴含有0(不形成球體)、1個、2個和2個以上球體的液滴的百分比。(e)圖表,顯示成功合并的液滴中含有完整、部分解體、解體和沒有球體的液滴的百分比,以及未能合并的液滴的百分比。2D,二維;3D,三維;DMA,液滴微陣列。
液滴融合與共培養:通過I.DOT向相鄰的“2D單層斑點”和“3D球體斑點”中各添加900nL新鮮培養基,液滴因體積增加跨越超疏水邊界,融合形成含兩種細胞形態的單一液滴(總容積約2000nL,圖1a;圖4d-e)。融合后2D細胞保持貼壁,3D球體懸浮于培養基中,二者無物理接觸,僅通過培養基進行旁分泌信號交換。
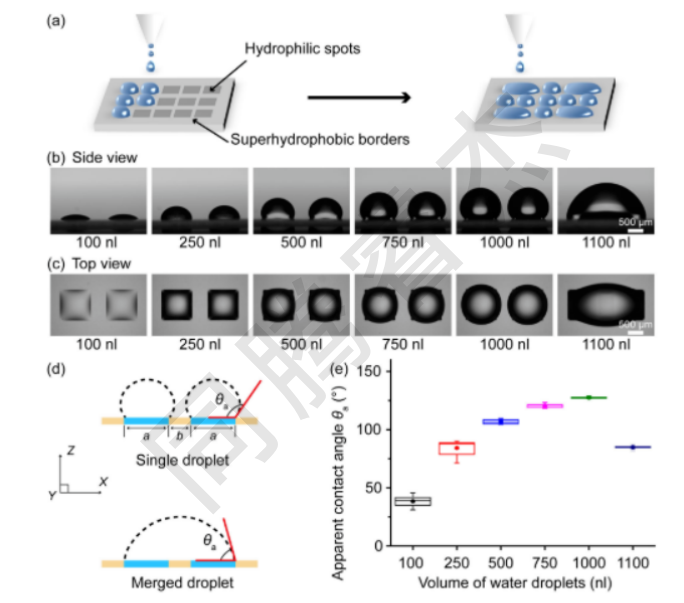
圖4. 控制兩個相鄰液滴的合并。(a)使用I.DOT分配和合并相鄰液滴的示意圖。DMA兩個相鄰親水點上不同體積的水滴的側視圖。(b)和俯視圖(c),DMA包含1 mm×1 mm的方形親水斑點,以及500微米的兩個斑點邊緣之間的超疏水邊界。(d)限制在親水斑點上的單個水滴和合并水滴的示意圖。(e)顯示不同體積的液滴的表觀水接觸角(θa)的曲線圖,范圍從100至1100 nL(n=10)。液滴微陣列。
檢測與分析:通過熒光顯微鏡(Keyence BZ-X800)觀察細胞形態;Hoechst 33342(總細胞)與PI(死細胞)染色評估活力(I.DOT打印50 nL染色液至每個斑點,孵育15min);Wnt信號實驗中,通過confocal顯微鏡(Zeiss LSM800)采集GFP熒光圖像,ImageJ量化熒光積分密度(定義為:平均熒光強度×細胞/球體面積),統計信號激活效率。
1、I.DOT保障
2D/3D細胞形態穩定性
2D單層完整性:I.DOT打印的HepG2細胞正置培養24h形成致密單層,即使倒置“懸滴”培養3天,僅1.5±0.3個細胞/斑點脫落(占總細胞數的1%,圖2b-c);液滴融合后,2D單層無破損,細胞活力維持在94.2%±2.1%(圖2g),證明I.DOT的打印與融合操作對細胞損傷極小。
3D球體均一性:經I.DOT打印100 nL抗黏附溶液后,92.99%的DMA斑點可形成單個3D球體(圖3d),球體圓形度>0.9,直徑變異系數<8%;正置培養3天內,球體無貼壁或解體,僅體積輕微增加5.2%(圖3c);液滴融合后,僅0.8%的球體出現破損(圖3e),驗證了3D形態的穩定性。
I.DOT打印的200 nL液滴在親水斑點上穩定存在(接觸角38°±4°,圖4e),當向相鄰斑點添加培養基至總容積達1100 nL時,液滴自發跨越超疏水邊界融合,形成接觸角85°±1°的穩定大液滴(圖4b-e);融合過程耗時僅110s/20組,且24h內無蒸發或滲漏(體積變化<3%),證明I.DOT可通過體積精準控制實現高通量液滴融合。
3、Wnt 信號雙向傳導:
共培養體系的功能驗證
3D→2D信號傳導:I.DOT構建“Wnt-3a分泌球體(3D)+報告細胞單層(2D)”共培養模型,融合后72h,報告細胞GFP熒光積分密度達297.1±91.0,是無Wnt-3a對照組(35.7±14.5)的8.3倍(圖5b-c),且熒光均勻分布于2D單層,證明信號從3D球體高效傳遞至2D細胞。
2D→3D信號傳導:反向構建“Wnt-3a分泌單層(2D)+報告球體(3D)”模型,融合后72h,報告球體GFP熒光積分密度達605.5±214.8,是對照組(68.2±35.7)的8.9倍(圖5f-g),且球體內部細胞均激活GFP,驗證了信號傳導的雙向性與完整性。
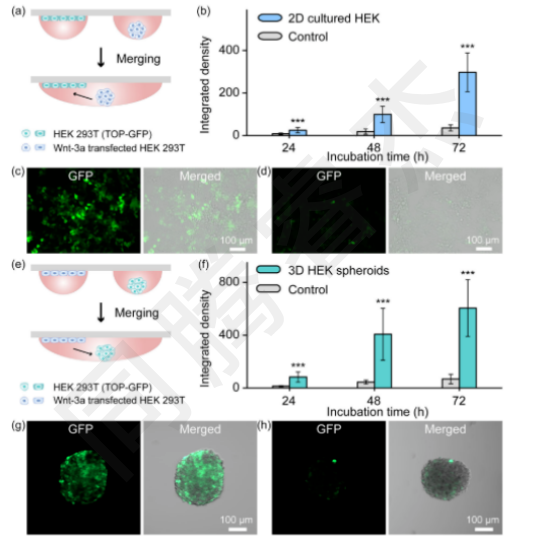
圖5. Wnt-3a在2D/3D細胞陣列中的旁分泌傳播和Wnt信號的激活。(a)頂端綠色熒光蛋白(GFP)熒光報告細胞在2D單層中與WNT-3a產生細胞球體共培養的工作流程示意圖。(b)共培養24、48、72小時后2D報告細胞積分密度的曲線圖。積分密度定義為平均綠色熒光蛋白熒光強度與細胞面積的乘積(n=30,*p<;0.001,單因素方差分析)。GFP激活的典型熒光圖像。(c)和對照實驗(不含WNT-3a);(d),(e)WNT-3a產生細胞在2D單層和TOP-GFP報告細胞中培養為球體的共培養工作流程示意圖。(f)顯示共培養24、48和72小時后3D報告球體的綜合密度的曲線圖。積分密度定義為平均綠色熒光蛋白熒光強度與球體面積的乘積(n=10,*p<;0.001,單因素方差)。GFP激活的典型熒光圖像。(g)和對照分析(在沒有WNT-3a的情況下)。(h) 2D,二維;3D,三維;DMA,液滴微陣列。
本研究基于DMA平臺開發的2D/3D細胞共培養體系,通過I.DOT非接觸式納升級移液技術實現了三大核心突破:首先是精準性革新,I.DOT解決了傳統共培養“細胞定位難、體積誤差大”的痛點,可實現“200 nL細胞懸液-100 nL抗黏附溶液-900 nL融合培養基”的均一操作,使2D細胞單層脫落率<1%、3D細胞球體單球率>92%,為旁分泌信號研究提供了穩定的微型化模型;其次是高通量與功能兼容,單塊DMA芯片含588個獨立斑點,可同步開展數百組共培養實驗(通量為Transwell的6倍),且體系兼容熒光成像、活力檢測與信號量化,成功解析了Wnt信號在2D與3D細胞間的雙向傳導,填補了“體外模擬體內細胞互作”的技術空白。
未來,I.DOT不僅可用于細胞信號傳導研究,還可拓展至癌癥侵襲(腫瘤球體與基質細胞共培養)、藥物篩選(評估藥物對2D/3D細胞互作的影響)、胚胎發育模擬(多細胞形態空間互作)等領域,結合I.DOT的自動化特性,可實現共培養實驗的規模化開展,為基礎生物學研究與轉化醫學提供“接近體內微環境”的高效工具;而I.DOT與DMA的協同,不僅重新定義了2D/3D細胞共培養的實現路徑,更推動了“超微量、高通量、功能化”細胞互作研究的發展,為解析復雜生物機制提供了全新技術范式。
1、Nsagha, D. S.; Njunda, A. L.; Kamga, H. L. F.; Assob, J. C. N.; Bongkem, E. A. HIV-1/HIV-2 Co-infection among Voluntary Counselling and Testing Subjects at a Regional Hospital in Cameroon. Afr. Health Sci. 2012, 12, 276?281.
2、Wejse, C.; Patsche, C. B.; Kuhle, A.; Bamba, F. J. V.; Mendes, M. S.; Lemvik, G.; Gomes, V. F.; Rudolf, F. Impact of HIV-1, HIV-2, and HIV-1+2 Dual Infection on the Outcome of Tuberculosis. Int. J. Infect. Dis. 2015, 32, 128?134.




