在組織工程和再生醫(yī)學(xué)領(lǐng)域,人工多細(xì)胞系統(tǒng)正變得日益重要。然而,體外重建復(fù)雜的組織結(jié)構(gòu)充滿挑戰(zhàn),急需能夠可控且高通量制造復(fù)雜多細(xì)胞結(jié)構(gòu)的方法。該文介紹一種創(chuàng)新的3D細(xì)胞培養(yǎng)方法——基于可編程液滴融合技術(shù)的多球狀細(xì)胞結(jié)構(gòu)組裝(proMAD方法)。這一方法不僅能夠精確控制細(xì)胞組成和空間分布,還能在迷你化、高通量的格式下重建模擬天然組織的復(fù)雜性,可應(yīng)用于細(xì)胞信號、腫瘤侵襲、胚胎發(fā)生和神經(jīng)發(fā)育等多種生物過程的研究。
I.DOT非接觸式移液器:
proMAD方法的技術(shù)核心及優(yōu)勢

proMAD方法無需支架,可以以高通量和小型化的方式自動形成球形組件陣列,以解決細(xì)胞-細(xì)胞通信中使用的細(xì)胞機(jī)制的復(fù)雜性。該方法的核心在于I.DOT非接觸式移液器,它能夠在納升至微升的范圍內(nèi),非接觸式地將液體從源頭轉(zhuǎn)移到目標(biāo)板。這意味著極低的死體積(<1 μL)和零交叉污染風(fēng)險,為細(xì)胞培養(yǎng)提供了前所未有的精確度和安全性。
與此同時,I.DOT搭載的DropDetection系統(tǒng),能夠?qū)γ總€液滴進(jìn)行計數(shù)和檢測,提供液體轉(zhuǎn)移性能和總體積的即時反饋。這不僅確保了實驗的可重復(fù)性和可靠性,還極大地提高了實驗效率。
利用該文作者已開發(fā)的液滴微陣列(DMA)平臺[1-3],它可以制造納米升液滴微陣列,其中液滴的形狀、大小和密度取決于被超疏水屏障包圍的親水性圖案的設(shè)計。DMA平臺可以在數(shù)百個單獨的納升液滴中培養(yǎng)和高通量篩選各種細(xì)胞類型,這些液滴作為獨立的小型化棲息地[4]。
在DMA平臺上使用懸滴法制備單細(xì)胞球體,使用了由14 × 14個親水點(每個1 mm × 1 mm)組成的DMA,點之間的距離為500 μm(圖1)。以HepG2細(xì)胞為例,將細(xì)胞懸液以200 nL的液滴形式通過I.DOT非接觸式移液器分配在DMA上,每個液滴含有的細(xì)胞數(shù)量可控制球體直徑(30-150 μm)。然后將DMA倒置,使細(xì)胞在液滴-空氣界面因重力驅(qū)動聚集,培養(yǎng)2天后形成單個球體(圖1a,1b)。采用以下打印順序:為融合4個液滴,將培養(yǎng)基依次添加到D2、E2、D3、E3點(圖1c中藍(lán)色點,每個點多添加900 nL DMEM);為了融合3個液滴,將培養(yǎng)基依次添加到A1、A2、B2點(圖1f中藍(lán)色點,每個點增加850 nL DMEM)。然后相鄰的液滴融合成一個。將載玻片倒置培養(yǎng)24、48、72、96 h。用Keyence軟件對球體或合并球體進(jìn)行觀察和成像。
proMAD方法的基礎(chǔ)是將額外體積的細(xì)胞培養(yǎng)基分配到相鄰的單個液滴中,并控制它們在超疏水屏障上的融合(圖1)。在相鄰的每個200 nL的液滴中加入900 nL的介質(zhì)(即每個點總共加入1100 nL),相鄰的液滴會自發(fā)合并成一個新的大液滴,并牢固地附著在兩個親水點上(圖1)。合并液滴后,將DMA載玻片再次倒置進(jìn)行培養(yǎng),使先前分離的兩個球體在液滴底部接觸,并使它們粘附融合成多球體復(fù)合物(圖1a)。同樣,通過增加多個相鄰液滴的體積來合并兩個以上的液滴(圖1c-h)。有趣的是,這導(dǎo)致了由多個單獨的細(xì)胞球體組成的融合球體的形成。為了融合兩種不同的細(xì)胞系,選擇了兩種不同的細(xì)胞系:HeLa RFP細(xì)胞和HEK 293T細(xì)胞。用共聚焦顯微鏡檢查合并的球體。
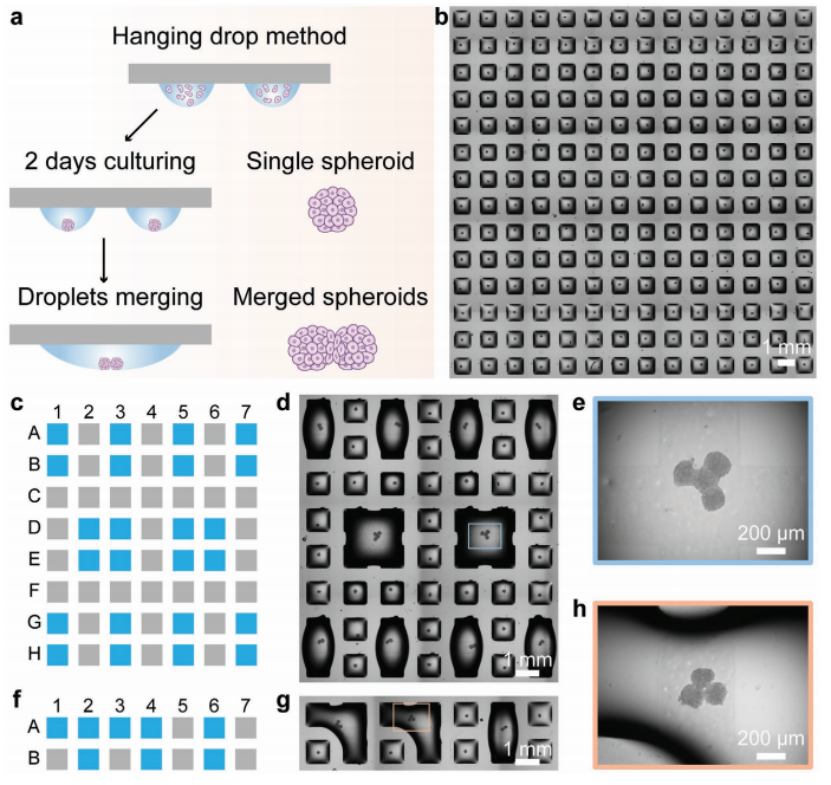
圖1. 可編程液滴融合技術(shù)(proMAD)。a)利用親水點被超疏水邊界分隔的小型化液滴微陣列(DMA)形成細(xì)胞球體陣列的示意圖。為了實現(xiàn)球體的可編程裝配,通過增加相鄰液滴的體積來合并液滴。b)單個HepG2球體14 × 14陣列顯微鏡圖像。c, f)多液滴在DMA上可控合并的打印方案。使用以下印刷體積:900 nL /液滴,用于融合2或4個液滴;850 nL /液滴,將3個液滴融合在一起((c)和(f)中的藍(lán)色點)。d, g)含有2、3和4個合并液滴的DMA顯微鏡圖像。e, h)融合24 h后融合水滴中的4個球體和3個球體圖像
1. 球體特征分析:使用ImageJ軟件測量和計算球體的圓形度、縱橫比、圓度和密實度等參數(shù)[5];
2. 融合過程分析:通過ImageJ軟件的角度工具測量兩個融合球體在不同融合時間點的夾角,用長度測量工具測量兩個球體之間融合區(qū)域(“頸部”)的長度[5];
3. 細(xì)胞活力檢測:融合后24 h收集雙球體,用 PBS 洗滌后,用 Calcein- AM和碘化丙啶染色15 min(37°C),然后通過熒光顯微鏡成像檢測細(xì)胞活力[5];
4. 免疫染色:收集并洗滌球體后,用 4% 多聚甲醛固定,0.5% Triton X - 100 透化,1% BSA 封閉,依次加入抗 - E - 鈣粘蛋白抗體和 Alexa Fluor 488 標(biāo)記的二抗,最后用 DAPI 染色,通過共聚焦顯微鏡成像[5];
5. 掃描電鏡固定:融合后 24 h 收集球體,用 PBS 洗滌,依次用 2.5% 戊二醛溶液固定、不同濃度乙醇和水脫水、50% 和 100% HMDS 處理,然后轉(zhuǎn)移到干凈玻片上干燥,通過掃描電子顯微鏡成像[5]。
6. 球體間Wnt信號傳導(dǎo):產(chǎn)生HEK 293T Wnt-3a,以及穩(wěn)定的HEK 293T TOP-GFP報告細(xì)胞系按照規(guī)劃程序進(jìn)行播種[6]。將產(chǎn)生Wnt的細(xì)胞打印在第1、3、5、7、9、11、13列,報告細(xì)胞打印在第2、4、6、8、10、12、14列。掛滴法培養(yǎng)2天后,每個點加入900 nL DMEM合并相鄰點。為了研究Wnt信號傳導(dǎo),每24小時用熒光顯微鏡和共聚焦顯微鏡檢查合并的球體。
1、對于融合的球體,定義了 “結(jié)合數(shù)” 來描述單個球體在融合過程中與相鄰球體的作用。在這個過程中,I-DOT對前期球體的精準(zhǔn)分配影響了后續(xù)融合的球體的各種數(shù)據(jù)。通過模擬算法和實驗結(jié)果統(tǒng)計量化了合并球體 “結(jié)構(gòu)異構(gòu)體” 的組合概率。例如,3個球體融合時有兩種可能的結(jié)構(gòu),線性組合A1A2A1和三角形結(jié)構(gòu)A2A2A2,實驗概率分別為61% 和39%,模擬算法得到的概率分別為85%和15%(圖2a);
除了融合可變數(shù)量的同源球體外,還可以融合由不同細(xì)胞類型形成的球體(圖2b)。在多細(xì)胞生物中,組織由多種具有空間組織的細(xì)胞類型組成,這些細(xì)胞類型協(xié)同工作以執(zhí)行特定功能。圖2b的結(jié)果顯示,即使在融合過程24小時后,異質(zhì)球體中兩種細(xì)胞類型之間仍有明確的邊界。因此,proMAD方法可以通過合并特定數(shù)量的相鄰液滴來實現(xiàn)單個球體的可控組裝,從而產(chǎn)生多球體聚集體,以及陣列格式的異質(zhì)球體架構(gòu)。
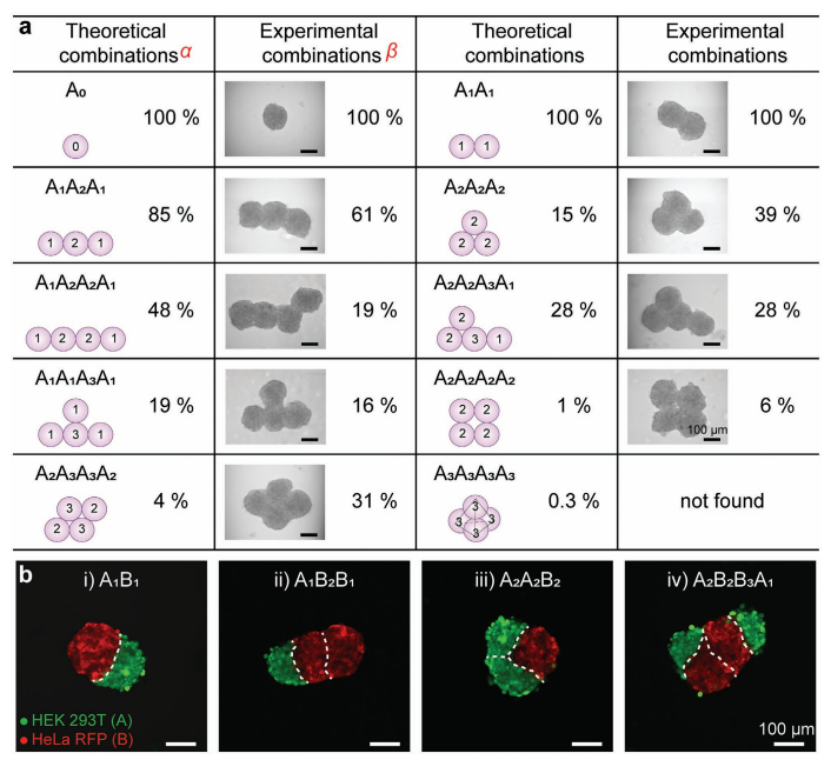
圖2. 由proMAD方法形成的多球體結(jié)構(gòu)的例子。a)不同HepG2多球體的示意圖、概率和相應(yīng)的例子。“結(jié)合數(shù)”對應(yīng)于配合物的各個球體之間的結(jié)合位點的數(shù)量,顯示在方案上的每個球體中。α,在理論模型中,將細(xì)胞球體視為球體,并通過模擬算法給出組合概率。β,組合概率由實驗統(tǒng)計得出(3個球體,n = 33, 4個球體,n = 32)。b)兩種不同細(xì)胞系(表達(dá)RFP和HEK 293T的HeLa細(xì)胞用綠色熒光5-氯甲基熒光素雙乙酸酯染色)合并后24小時構(gòu)建的異球結(jié)構(gòu)的熒光顯微鏡圖像:A1B1,A1B2B1,A2A2B2和A2B2B3A1。
2、為了觀察球體融合的過程,我們在液滴融合后的5天內(nèi),在規(guī)定的時間點用顯微鏡監(jiān)測了兩個球體融合在一個液滴中的情況(圖3a)。兩個HepG2球體首先融合成花生狀結(jié)構(gòu),水滴融合后24-96 h形成固體融合橢圓形結(jié)構(gòu)(圖3a)。在觀察兩個球體融合過程中,測量了融合點的切線角度和融合區(qū)域的長度。融合2 h后,兩個原始球體的形狀仍可清晰辨認(rèn),夾角在57° ± 16°到154° ± 11°之間,融合區(qū)域長度約為40.7 ± 6.8 μm;48 h后夾角大于,96 h完全融合時夾角接近,融合區(qū)域長度逐漸增加到138 ± 10μm(圖3c),共培養(yǎng)48 h后,合并后96 h,兩個球體之間的夾角在110°以上,逐漸接近180°,完全融合(圖3a,b)。我們稱之為“頸部”的合并區(qū)域的長度(圖3a,橙色虛線)。
此外,作者還使用細(xì)胞-細(xì)胞相互作用模型來模擬兩個球體的融合過程(圖3d)[7]。熱圖(圖3e)顯示了融合過程中單個細(xì)胞的相對位移,表明球體中的細(xì)胞已經(jīng)重新分布,形成新的橢圓形結(jié)構(gòu)。在我們的實驗和模擬中,融合后96 h雙球體的總長度分別減少了約18%。
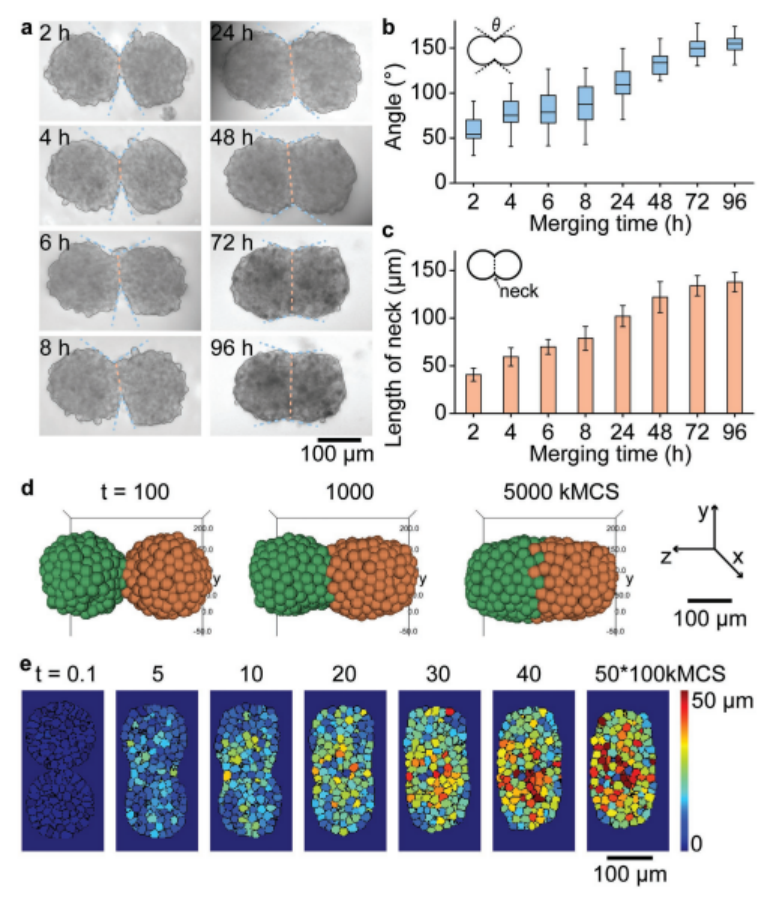
圖3. 兩胞球體融合過程的實驗與模擬研究。a)兩個HepG2球體初次接觸96小時后融合的亮場顯微鏡圖像。b)合并球體間夾角隨時間變化的曲線圖。(a)中的藍(lán)色虛線表示角度。c)顯示合并球體隨時間變化的頸部長度(橙色虛線顯示在(a)中)的圖。(b)和(c)中的誤差條表示10個不同合并球體的SD。d)兩個球體(球體直徑150μm, 400個細(xì)胞)融合過程的三維模擬。e)熱圖顯示融合過程中單個細(xì)胞的時空運(yùn)動。彩色地圖表示每個細(xì)胞相對于其初始位置的位移(t = 0)。kMCS是時間尺度,代表kilo Monte Carlo sweep。
3、為觀察兩球體合并區(qū)域細(xì)胞狀況,進(jìn)行了E-cadherin免疫染色和掃描電鏡成像(圖4a)。E-cadherin免疫染色用于可視化細(xì)胞粘附和連接[8],結(jié)果顯示在融合的雙球體內(nèi)均勻分布,表明球體是生物融合而非物理吸附。掃描電鏡成像證實了 “花生” 形融合復(fù)合體的形成及單個球體界面細(xì)胞間的緊密相互作用(圖4b)。這些結(jié)果表明,用特定方法獲得的多球體三維結(jié)構(gòu),在球體之間具有緊密的細(xì)胞間接觸,利于研究細(xì)胞間相互作用及相關(guān)生物過程。

圖4. 兩胞球體融合過程的實驗與模擬研究。多球體結(jié)構(gòu)中的細(xì)胞-細(xì)胞相互作用。a)融合24 h后兩個HepG2球體的熒光顯微鏡圖像。e -鈣粘蛋白染色(綠色熒光)顯示細(xì)胞間連接。DAPI(藍(lán)色熒光)顯示細(xì)胞核。合并:DAPI覆蓋層,E-Cadherin染色。b)融合后球體(HepG2,融合后24 h)的SEM圖像。左圖是在2000倍放大率下拍攝的。右上方圖像(藍(lán)框)在7000倍放大下顯示單個球體內(nèi)細(xì)胞-細(xì)胞接觸。右下角(橙色框)在7000倍放大下顯示了雙球體的接觸“頸部”區(qū)域。
4、使用proMAD方法將產(chǎn)生Wnt的球體(HEK 293T, Wnt-3a)與報告球體(HEK 293T, TOP-GFP)融合(圖5a)。融合后24和48小時,通過測量TOP-GFP報告球體的熒光強(qiáng)度來監(jiān)測Wnt信號活性(圖5b)。報告球體共培養(yǎng)24 h后平均熒光強(qiáng)度為45.3 ± 10.0,共培養(yǎng)48 h后平均熒光強(qiáng)度為58.3 ± 5.7(圖5b)。共培養(yǎng)48小時后,整個報告球體顯示出均勻的GFP熒光,表明在球體的所有細(xì)胞中Wnt信號被強(qiáng)烈激活(圖5c-i,ii)。對照實驗僅顯示較弱的GFP強(qiáng)度(圖5c-i,ii) [9,10],融合后24和48 h的平均熒光強(qiáng)度分別為3.0 ± 1.1和2.9 ± 0.9。在Wnt-3a存在下,TOP-GFP Wnt報告球體的熒光強(qiáng)度比對照球體增加了約15倍(24 h)和大約20倍(48 h)。
接下來,研究測試了Wnt信號在三重球體復(fù)合體中的傳播,將兩個報告球體與一個產(chǎn)生Wnt-3a的球體合并,然后選擇兩種不同的融合球體架構(gòu)進(jìn)行分析。在第一種結(jié)構(gòu)中,兩個報告球體呈線性結(jié)構(gòu)排列,產(chǎn)生Wnt的球體位于一端(圖5d)。與產(chǎn)生Wnt直接相鄰的報告球體被強(qiáng)烈激活,而位于遠(yuǎn)端的報告球體被不那么強(qiáng)烈激活(圖5d,f)。在第二種組合中,兩個報告球體位于生產(chǎn)者球體的兩側(cè),顯示出兩個報告球狀體在同等程度上的強(qiáng)烈激活(圖5e,g)
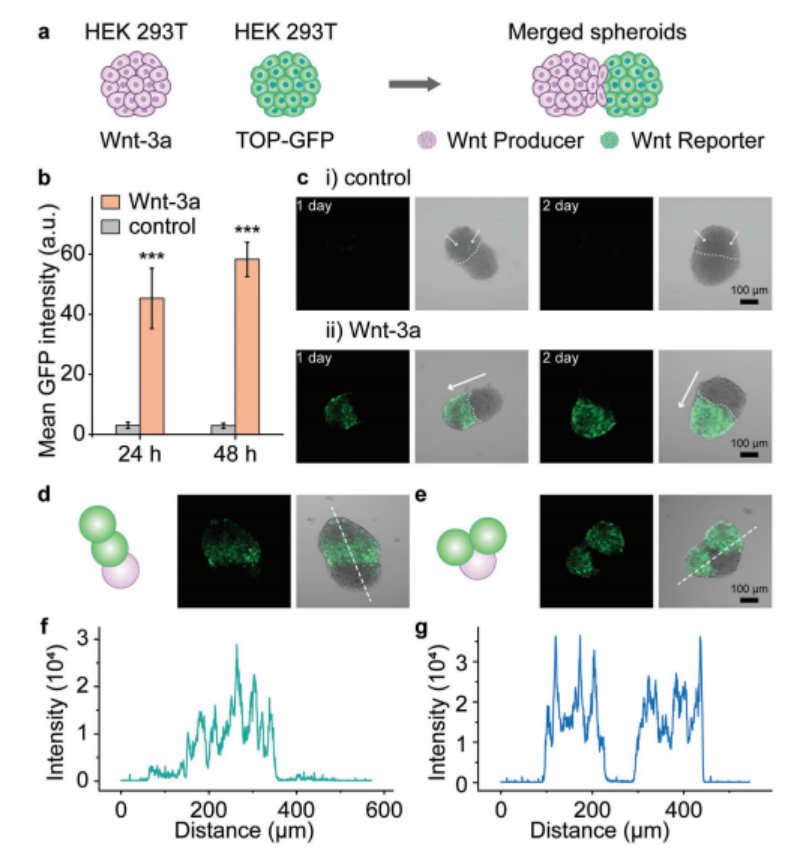
圖5. 合并球體之間的Wnt信號。a)由產(chǎn)生球體(HEK 293T、Wnt-3a)和報告球體(HEK 293T、TOP-GFP)組成的多球體復(fù)合物構(gòu)成的Wnt信號傳播系統(tǒng)示意圖。b)報告球體激活圖。通過共聚焦圖像中GFP熒光的強(qiáng)度來估計激活。(GFP強(qiáng)度由至少10個合并的球體計算。***, P < 0.001,單因素方差分析)c)共聚焦圖像顯示GFP熒光估計報告球體中Wnt/β-catenin信號的激活。i) HEK 293T球體(對照)和報告球體的合并球體。白色箭頭指向微弱的GFP熒光。ii)一個Wnt產(chǎn)生球(HEK 293T)和一個Wnt報告球(HEK 293T, TOP-GFP)的合并球。白色箭頭指向Wnt傳播方向。d,e)所研究的兩個三重球體的示意圖和熒光顯微鏡圖像,其中一個Wnt產(chǎn)生球體(HEK 293T)和兩個Wnt報告球體(HEK 293T, TOP-GFP)。f)如圖(d)所示三重球體白色虛線上GFP熒光強(qiáng)度分布圖。g)如圖(e)所示三重球體白色虛線上GFP熒光強(qiáng)度分布圖。
本文通過proMAD方法成功實現(xiàn)了多個同型或異型球體的融合,形成了雙球體、多球體和異質(zhì)球體等各種多球體結(jié)構(gòu),并確定了不同結(jié)構(gòu)的組合概率。與現(xiàn)有的3D細(xì)胞培養(yǎng)方法相比,proMAD方法具有諸多獨特優(yōu)勢。如高通量、小型化、已操作及快速形成復(fù)雜多極結(jié)構(gòu)等。I-DOT在前期球體的制備過程中保證了每個液滴的準(zhǔn)確性,間接影響了最終多球體結(jié)構(gòu)的形成。同時,該方法也為研究3D細(xì)胞培養(yǎng)模型中的細(xì)胞信號傳導(dǎo)提供了強(qiáng)大工具,I-DOT在多個關(guān)鍵步驟中發(fā)揮重要作用的同時,更有助于在更接近生理條件下研究各種生物學(xué)過程,為組織工程和再生醫(yī)學(xué)的發(fā)展提供新的思路和方法。
同騰睿杰(上海)生物技有限公司作為CYTENA I.DOT中國總代理商,為您提供優(yōu)質(zhì)的售前售后服務(wù)。
聯(lián)系電話:021-50826962
聯(lián)系郵箱:sales@ttbiotech.com




