蛋白和蛋白以及蛋白與底物之間的相互作用,對蛋白的功能至關重要。而這些相互作用常受到一些較難發現的因素影響。因此,一種生物化學和生物物理學相結合的方法(其基于電驅動的DNA生物芯片和單分子質量分析,)用于對一種轉錄因子,叉頭狀蛋白P2(FOXP2)的DNA結合和蛋白寡聚化能力從蛋白性能的不同方面進行分析鑒定。FOXP2蛋白包含核酸結合和蛋白寡聚結構域,例如C2H2-鋅指域和一個亮氨酸拉鏈域,該結構域的作用目前仍舊不清楚。我們發現亮氨酸拉鏈域通過卷曲螺旋-卷曲的結構形式介導FOXP2的二聚化,同時輔助蛋白和DNA的結合。當鋅指域的卷曲-卷曲結構完整時,該結構域有助于蛋白二聚化,但該結構域不涉及DNA的結合。叉頭狀結構域是驅動蛋白和DNA結合的主要結構。我們的研究發現有助于理解FOXP2蛋白轉錄活性調控機制。
叉頭狀轉錄因子P2(FOXP2)在哺乳動物中央神經系統的基因表達調節方面發揮重要的作用。在胚胎發育過程中,人類的FOXP2蛋白表達在各種組織,例如大腦,肺,小腸和心臟。FOXP2涉及上千基因的轉錄調節,其活性的失調和人類癌癥發生發展相關。人類的FOXP2尤其引人關注,因為它與一種可遺傳的言語和語言障礙存在關聯。位于FOXP2叉頭狀結構域的一個R553H的無義突變破壞了該因子和DNA結合的能力,嚴重的損傷了人類大腦的正常功能。
含有714個氨基酸的人FOXP2蛋白由多個結構域和基序組成,該特征可以從其一級結構中看出。除了叉頭狀結構域,蛋白還包括一個富含谷氨酰胺的區域,一個鋅指域和一個亮氨酸拉鏈結構域。人FOXP2蛋白的富含谷氨酰胺的結構域包含40個連續的谷氨酰胺序列,是人類蛋白質組中最長的天然發生的多聚谷氨酰胺序列。多聚谷氨酰胺序列可以形成a-螺旋結構,該結構通過形成卷曲螺旋介導蛋白和蛋白的相互作用。
高度保守的叉頭狀結構域,位于人類FOXP2蛋白的C端,能夠識別出含7個堿基的核酸保守序列結合位點。叉頭狀結構域也有能力介導同源蛋白和蛋白的相互作用。在叉頭狀的晶體結構中顯示該結構經歷了重排,導致叉頭二聚物結構域的交換。這種結構域的交換似乎是FOXP2蛋白及其同源蛋白FOXP1,FOXP3和FOXP4的適應性結構特征,用以介導DNA成環或內部染色體的相互作用。
人類FOXP2蛋白的鋅指基序為含C2H2的經典基序,是人類蛋白質組中最常見的蛋白基序。C2H2鋅指基序也介導了同源蛋白和蛋白的互作。與大多數鋅指蛋白不同,人的FOXP2僅包含單個的C2H2鋅指序列,其保守區域為C-X4-C-X12-H-X4-H,X代表任何氨基酸。人FOXP2中的鋅指基序是否涉及DNA結合和/或蛋白互作,仍舊不清楚:在酵母雙雜交系統中,刪除該序列并不影響蛋白的轉錄抑制功能。
FOXP2蛋白的亮氨酸拉鏈結構域有助于蛋白和DNA的結合,促進了蛋白同源和與FOXP1,FOXP2及FOXP4的異源相互作用。在細胞內部環境下,FOXP蛋白非常保守,能夠與自身或同源蛋白及細胞內的其他蛋白發生互作。FOXP2是一個復雜精細的多功能蛋白。僅對叉頭狀結構域的分析,并不能顯示FOXP2蛋白和其本身以及和其底物DNA之間互作的完整效應。因此,本文中我們分析了鋅指基序,亮氨酸拉鏈以及叉頭狀結構域在DNA-FOXP2及FOXP2-FOXP2之間互作的效應功能。
我們利用基因工程的手段制備了FOXP2的七種突變體,用以研究FOXP2蛋白的相應結構域在DNA結合以及蛋白同源寡聚化過程中的作用(請見Figure 1a)。
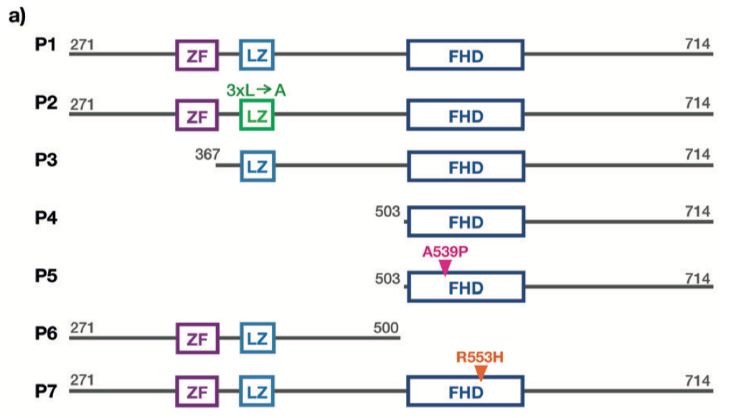
FOXP2蛋白的突變體示意圖
在非變性凝膠阻滯實驗中,將攜帶有經證實的保守的FOXP2結合序列(TGTTTAC)的雙螺旋DNA滴定入固定濃度的蛋白突變體中(請見Figure 1b)。

對于含有全部結構域的突變體P1,低濃度DNA時,所有的DNA都被聚集在低遷移率的條帶中,說明了DNA-蛋白復合物的形成。增加DNA的濃度導致這些條帶遷移速率的增加,表明每個DNA分子結合了更少的蛋白分子。最終,當我們將DNA的濃度增加到每個DNA分子和蛋白分子的化學計量比為4時,自由DNA量明顯增加。上述結果與僅含有叉頭狀結構域的蛋白突變體P4的EMSA滴定結果相反。在較低的DNA濃度時,自由DNA已經存在,高度有序的DNA-蛋白復合物很難被檢測到。因此,與突變體P1相比,截短的P4突變體與DNA結合的親和性明顯降低。
蛋白突變體P1和不同長度的DNA靶點以及不同的保守結合位點的混合EMSAs實驗顯示,不同的保守基序能夠被蛋白有效的進行分群(請見Figure 1c)。
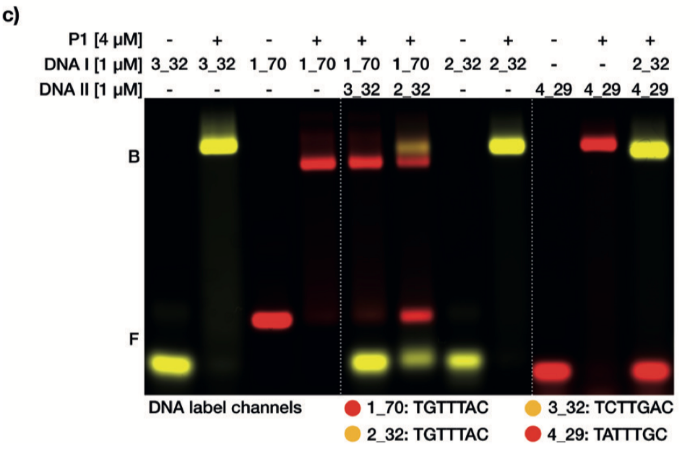
當將兩個具有不同序列的DNA靶分子混入相同的蛋白樣本中時,蛋白將根據相對親和性區分靶分子。確實,與TATTTGC或TCTTGAC相比,我們發現蛋白突變體P1更傾向于與TGTTTAC序列結合。當蛋白突變體P1與相同的TGTTTAC序列,但分別為32或70個堿基對的序列混合時,蛋白并未表現出結合偏向。
EMSA實驗凝膠遷移結果常出現大量的條帶彌散現象,是由于在非平衡的凝膠電泳實驗條件下,凝膠基質中含有大量的不穩定的蛋白-DNA復合物引起的。通過EMSA進行DNA-蛋白結合親和性的定量實驗并不可行。我們因而借助于以熒光接近感應(FPS)的DNA生物芯片技術(請見Figure 2)。

熒光接近感應(FPS)switchSENCE技術
在FPS測量中,我們監測到含有FOXP2結合保守序列的DNA靶分子的熒光強度發生變化,然而包含錨定雙螺旋或更長的陰性對照組未檢測到明顯的熒光強度的改變(請見Figure 2c)。
為了檢測鋅指基序,亮氨酸拉鏈和叉頭狀結構域對FOXP2與DNA的結合的影響,我們在生物芯片上利用不同的突變體進行濃度依賴性的結合親和性檢測。對于突變體P1-P5,都包含叉頭狀結構域以及突變體P6和P7,可參考Figure 1a中的蛋白結構示意圖。一旦蛋白加入流動系統,熒光強度增加,當蛋白被洗脫時,熒光強度降低(請見Figure 3a)。在這兩個階段中,信號最終都達到穩態。隨著蛋白濃度的不同,穩態期的熒光強度存在差異。更高的蛋白濃度產生更高的絕對熒光強度(請見Figure 3a)。因此,蛋白濃度的增加導致表面附著的DNA中被蛋白占據的比例增加,與可逆結合反應的預期一致。當蛋白被洗脫時,穩態期的熒光強度會恢復到蛋白結合之前的狀態,表明所有結合的蛋白都被解離。
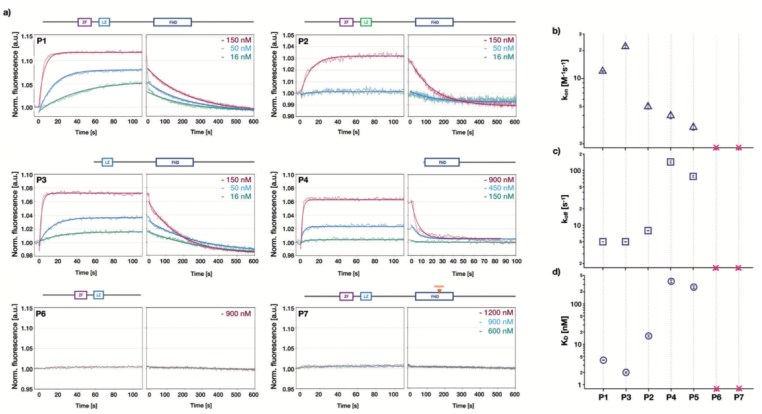
FOXP2蛋白突變體和DNA結合動力學
突變體P1,包含所有功能性結構域,即使在蛋白濃度為150nM時,穩態期的熒光強度也出現較大幅度的增長。然而,僅含有叉頭狀結構域的P4突變體需在900nM的蛋白濃度時,產生相同強度的熒光。對于突變體P6和P7,我們未能檢測到熒光強度的改變,說明在測試的濃度范圍內(達到1.2uM),這些突變體未能和DNA發生結合。我們采用全局動力學擬合模型,結合濃度依賴性的熒光時間曲線以及雙分子反應模型,以提取結合速率常數Kon以及解離速率常數Koff。根據解離和結合常數之比,確定蛋白和DNA互作的解離平衡常數Kd,數值從大約2nM到大約360nM,根據蛋白突變體不同發生變化(請見Figure 3d)。
為了對人的FOXP2和其本身的互作進行定量,我們利用single-molecule mass-photometry landing assays技術測量蛋白分子的質量和聚合狀態(請見Figure 4a)。
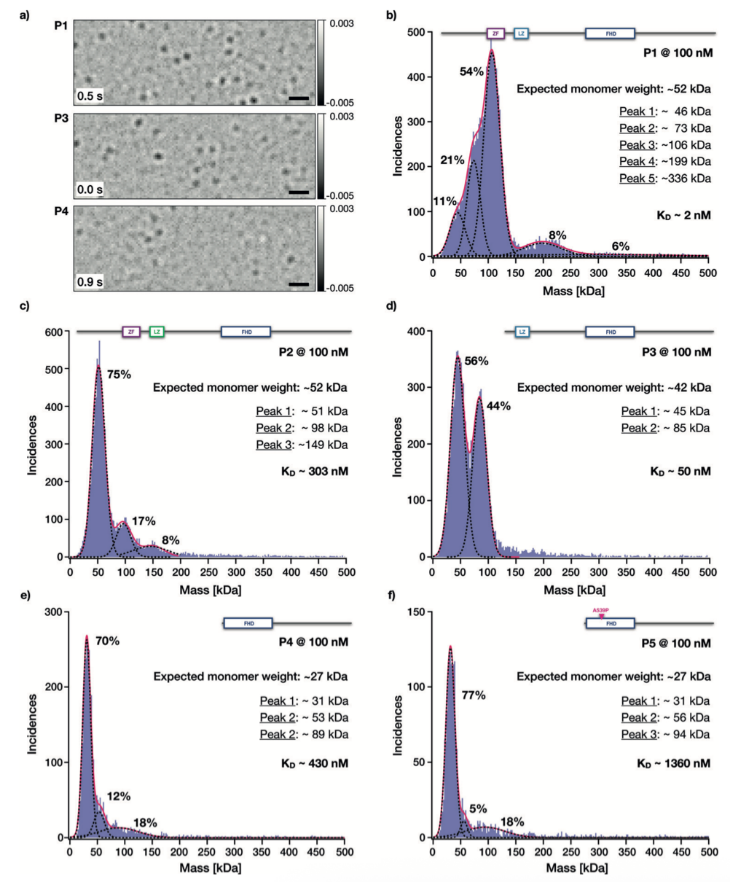
FOXP2蛋白突變體的質量光譜結果
蛋白突變體P1是研究中最長的FOXP2突變體,至少存在五種不同的質量分布(請見Figure 4b)。被分析的顆粒中,一半來自于分子量大約為100kDa的顆粒。因為P1單體的分子量是該數值的一半,我們認為顆粒中大多數是FOXP2二聚體。在P1的質量分布中,更大的分子質量是200 kDa,該數值是100 kDa的整數倍,因此,我們認為該分子聚集體是FOXP2二聚體的二聚體。我們也檢測到兩個低分子量的分子分布,其中一個是46 kDa,另一個是73 kDa。前者可認為是帶有測量誤差的FOXP2單體,后者可能由于雜質引起的無法定性的分子。
對于蛋白突變體P2,由于在亮氨酸拉鏈域含有三個亮氨酸替換丙氨酸的突變,我們獲得了完全不同的分子質量分布結果。75%的顆粒的平均分子量為51 kDa,非常接近52 kDa的P2單體分子量。我們因此推測該顆粒為單體形式。分子量更高的顆粒質量分別為100 kDa和150 kDa,因為該數值是50 kDa的整數倍,我們推測該顆粒分別為P2的二聚體和三體。
蛋白突變體P3,含有激活的亮氨酸拉鏈域,但缺少鋅指基序,我們獲得了45 kDa和85 kDa的分子顆粒(請見Figure 4d)。P3的預測分子量為42 kDa,因此我們推測這兩種顆粒分別為FOXP2蛋白的單體和二聚體。
對于僅含有叉頭狀結構域的突變體,推測分子量為27 kDa。經測得P4突變體的分子量分布分別為31 kDa,53 kDa和89 kDa。突變體P5測得的分子量分布分別為31 kDa,56 kDa和94 kDa。在測量誤差范圍內,我們鑒定其分別為單體,二聚體和多聚體。
我們將從FPS測量中獲得的解離常數和從質量光譜中獲得的解離常數進行了對比,推測分子相互作用的自由能。蛋白突變體P1和P3具有同樣的DNA結合強度,Deta G約等于-12 kcalmol-1。因為P3突變體中刪除鋅指基序并未影響突變體與DNA的結合,我們推測鋅指基序并不能直接和被研究的DNA靶序列相互作用。突變體P3(含有亮氨酸拉鏈和叉頭狀結構域)和P4(僅含有叉頭狀結構域)的對比結果表明,刪除亮氨酸拉鏈結構域會削弱蛋白與DNA的結合能力,削弱程度達到Deta G約為3 kcalmol-1。因此,亮氨酸拉鏈與DNA存在相互作用。在蛋白突變體P2中,我們將亮氨酸拉鏈區域的三個亮氨酸替換丙氨酸,進而打破了內部重復序列,該序列對蛋白的寡聚化具有明顯的作用:具有亮氨酸拉鏈和鋅指基序的P1突變體的蛋白互作親和性Kd為2nM,然而,重復序列被打破的P2突變體,其蛋白互作的Kd為300nM。因此,打破重復序列會削弱蛋白二聚體的穩定性,其程度達到Deta G約為3 kcalmol-1。
與突變體P1相比,刪除鋅指基序的P3突變體,會削弱蛋白二聚化的穩定性,其程度達到deta G約為2 kcalmol-1。因此,鋅指基序有助于蛋白之間的相互作用。然而突變體P2,其包含鋅指基序和七聯體重復序列被破壞的亮氨酸拉鏈域,顯示其蛋白互作的強度與僅包含叉頭狀結構域的突變體P4在數值上相一致。因此,我們將在P2中檢測到的蛋白互作歸因于叉頭狀結構域之間的互作,而不是由亮氨酸拉鏈或鋅指基序所介導。似乎只有當亮氨酸拉鏈結構域形成卷曲螺旋結構時,鋅指基序才會參與蛋白之間的相互作用。
蛋白突變體P4和P5,僅由叉頭狀結構域構成,顯示了DNA結合能力,其結合親和性Kd值為300nM(Deta G約為9 kcalmol-1)。叉頭狀結構域可以和DNA直接相互作用,這與已有的報道相一致。加入亮氨酸拉鏈結構域能夠增強蛋白與DNA結合的穩定性,其結合親和性為2nM。在結合能方面,FOXP2的亮氨酸拉鏈或鋅指基序有助于蛋白-DNA之間相互作用的能量提高,其程度約為Deta G kcalmol-1。
僅含有叉頭狀的結構大多數以單體的形式存在,但殘留的二聚體/單體平衡使得我們能夠推測蛋白和蛋白結合的強度。相應的,P4和P5的發生二聚化的能量分別需要Deta G 8.8 kcalmol-1和8.1 kcalmol-1。
總的來說,質量光譜和利用熒光接近感應(FPS)的swithcSENCE技術分別從復合體形成的熱力學和實時結合動力學兩個方面研究蛋白與靶分子的相互作用性能。這對于我們更深入的研究蛋白互作至關重要。




