目前,電驅動的DNA納米桿相關技術,被用于檢測流感病毒,比如Influenza A/Aichi/2/1968,與其受體蛋白/肽PeB的相互作用。該受體蛋白能夠與病毒顆粒表面的血球凝集素蛋白特異性的結合。
該技術被稱為switchSENCE,其原理是將DNA鏈錨定在生物芯片的表面,并將受體肽PeB與DNA鏈進行耦合,以實現(xiàn)將受體肽固定在芯片表面的目的。同時,其中錨定在芯片表面的單鏈DNA攜帶熒光基團,而與其互補的DNA鏈則根據(jù)研究的需要,可以設計攜帶多價肽等受體分子。形成的雙鏈DNA納米桿,在芯片電極提供的負電壓條件下,可以保持直立的靜止狀態(tài)。信號的檢測基于互作事件發(fā)生后,對熒光基團周圍環(huán)境的改變,導致了熒光信號改變的發(fā)生。本研究中,病毒顆粒與肽的相互作用信號的產(chǎn)生說明病毒可以直接做為配體,特異性與固定在芯片表面的受體肽結合,且在較長的時間范圍內(nèi),病毒能夠保持正常活性,處于穩(wěn)定的結合狀態(tài)。此外,通過該技術,可以比較不同的病毒亞型與同一受體肽的結合性能。總的來說,本研究證實switchSENCE技術可以利用病毒本身做為研究材料,在病毒顆粒原生態(tài)的環(huán)境下檢測受體與病毒表面配體的互作性能。
流行性病毒的爆發(fā),給人類的生命健康帶來極大的威脅,比如嚴重急性呼吸綜合征冠狀病毒(SARS-Cov-2)的發(fā)生及流行。帶來類似嚴重后果的還有在1918年爆發(fā)的A型流感病毒Spanish flu, 導致了全世界數(shù)百萬人口的死亡。A型流感病毒屬于正黏病毒科,其具有脂質雙層膜結構,膜的表面表達三種膜蛋白:血球凝集素蛋白(HA),神經(jīng)氨酸苷酶(NA)和M2質子通道蛋白。神經(jīng)氨酸苷酶可以促進病毒顆粒從被感染的細胞釋放,并裂解糖苷酶鍵;HA可以在病毒與細胞融合之前,與細胞表面含有唾液酸(SA)的細胞受體結合。HA為同源三聚體結構,在其蛋白的球形頭部結構域攜帶三個SA結合位點。單價肽與病毒的結合的親和性在mM級,但HA在病毒表面廣泛表達,可與多個SA分子發(fā)生互作,表現(xiàn)出更高的結合性能,我們也將其稱為avidity。對病毒與其受體結合的affinity與avidity的研究,將可以幫助我們更有效的理解病毒內(nèi)化和感染的過程。由于其復雜的結合形式,需要新的技術手段對其進行檢測分析。例如,表面等離子共振技術(SPR),核磁共振技術,或者電測量等。
本研究中,我們利用switchSENCE技術,對HA和其受體肽的結合動力學進行了檢測。該技術是利用電子驅動的DNA納米桿實現(xiàn)。該DNA納米桿通過化學作用,與生物芯片進行結合。該技術已經(jīng)廣泛用于蛋白-蛋白,蛋白-核酸適配體以及蛋白-DNA等分子之間的互作分析。而本研究是將該技術第一次用于病毒-肽的互作檢測。
switchSENCE技術,不僅可以檢測分子互作之間的親和性(KD),同時可以實時檢測結合常數(shù)(Kon)和解離常數(shù)(Koff)。在藥物發(fā)現(xiàn)研究領域,這些分子互作參數(shù),對于潛在藥物性能的評估至關重要。分子互作的親和性,可以通過傳統(tǒng)的MST,ITC等技術進行檢測,但是它們無法測量實時的結合和解離常數(shù),并且需要進行熒光標記,而switchSENCE技術可以在不標記互作分子的情況下,檢測其相互作用動力學參數(shù)。與其相似的傳統(tǒng)技術有表面等離子共振技術(SPR),兩者在測量分子互作方面具有非常多的相似性和優(yōu)點,比如:(1)不僅可以測量親和性,同時可以實時檢測動力學參數(shù);(2)都不需要進行標記;(3)較低的樣本消耗量;(4)數(shù)據(jù)檢測的較高靈敏度;兩種技術也有相似的不足之處,比如:(1)都需要將其中一個分子進行固定,固定本身可能會影響分子互作性能的檢測;(2)微流控下的物質運動的限制;(3)非特異性結合發(fā)生的可能性。不論是SPR還是switchSENCE技術,對數(shù)據(jù)的解讀都非常重要,需要研究人員的經(jīng)驗和對儀器的深入了解,以實現(xiàn)對結果進行科學合理的評估。
和SPR相比,switchSENCE技術具有相應的優(yōu)勢,其中之一是可以控制受體在其表面結合的密度,以減少分子的聚集,并可以按照不同比例分布兩種不同的分子。此外,switchSENCE技術由于利用了DNA互補雜交原理,因此可以應用于多種類型的分子互作場景;尤其當待檢測的受體分子是DNA為基礎的結構,比如DNA-肽納米結構,更具有操作上的優(yōu)勢。除此之外,switchSENCE技術還能夠用于測量蛋白構象變化以及流體動力學半徑測量,這些是SPR無法實現(xiàn)的功能。
PeB受體肽起源于單克隆抗體HC19免疫球蛋白可變區(qū)域的互補決定區(qū),已經(jīng)報道,其對HA2, NA3具有中和效應。已經(jīng)證實,它能夠與A型流感病毒株Aichi H3N2的HA蛋白結合,其親和性在uM級。雖然該親和性相比單價分子間親和性已大大提高,對于治療型抗體的效率來說,仍舊需要進一步優(yōu)化和提高。
為了實現(xiàn)進一步優(yōu)化的目的,許多改進的方法嘗試多價互作的形式,以增強小分子配體與生物受體復合物的靶向效率。對于流感病毒的HA受體,其唾液酸配體的結合位點為有序排列的三聚體復合物,兩個鄰近位點之間的距離大約為4.2nm。在一些實驗設計中,以DNA或其它核酸為基礎的納米桿,已經(jīng)做為一種呈遞HA結合配體的骨架,應用于研究中。由于該骨架操作的靈活性,可以呈遞單價,二價或三價配體,因此提高了分子之間的結合性能;該設計的第二個優(yōu)勢,體現(xiàn)在遵循沃森-克里克的堿基互補配對原則的DNA骨架設計,使得多種類型的分析檢測更加的直觀化。通過延長非配對的單鏈序列,使其可以做為簡單的模塊,與互補配對鏈共同錨定在分析檢測表面。例如,本研究第一次報道了,利用switchSENCE技術對病毒與錨定在芯片表面的DNA-肽的互作動力學進行檢測。
互作分析通過以switchSENCE技術為基礎的DRX2(Dynamic Biosensors GmbH, Germany)儀器實現(xiàn)。使用的芯片為MPC-48-1-R1-S 或 MPC2-48-2-G1R1-S(Dynamic Biosensors GmbH)。每個微流控芯片由四個獨立的液流通道組成,詳情見Figure 1a。
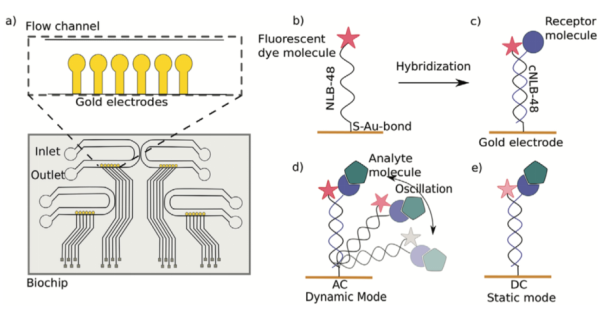
Figure 1: 生物芯片結構及DNA納米桿結構示意圖
每一個通道寬1mm, 高60um, 包含六個金屬電極,長度為3.34mm, 每個電極直徑為120um, 其與電源相連。每一個電極都與DNA納米桿相連接。單鏈DNA納米桿(NL-B48,序列請見Table 1)通過5’端與芯片表面共價結合,在序列3’端攜帶有用于信號檢測的熒光基團。互補配對的DNA鏈(cNL-B48,序列請見Table 1),可以與待檢測的目標分子進行交聯(lián)。在本研究中,受體肽(SA)與互補配對的DNA鏈進行交聯(lián)。通過DNA分子雜交,使得互補配對鏈DNA-肽與芯片表面的DNA鏈進行結合,形成雙鏈DNA。該雙鏈DNA可以用于后續(xù)的電驅動的互作分子檢測。其結構請參見Figure 1。由于電源可以交替產(chǎn)生正/負電壓(AC),因此能夠使得帶有負電荷的雙鏈DNA在芯片表面進行擺動,被稱為“dynamic mode”;電源也可以是保持不變的負電壓(DC),使得DNA雙鏈保持直立狀態(tài),被稱為“static mode”。對于動力學模式,AC電壓的范圍是-0.3V到0.5V,變化頻率為10kHz. 在動力學模式下進行測量時,當DNA雙鏈接近金屬電極時,由于發(fā)生能量轉移,熒光信號發(fā)生淬滅,當其離開芯片表面時,熒光強度增強,進而產(chǎn)生周期性的熒光信號的改變。改變過程中發(fā)生的熒光光子數(shù),通過實時的單光子計數(shù)技術(e-TCSPC)進行檢測。在結合事件發(fā)生后,由于整體納米桿的流體動力學摩擦系數(shù)的增加,造成了DNA納米桿在該流體系統(tǒng)中運動速率的減慢,速率的變化可以通過實時的熒光變化進行檢測。在靜止模式下,電壓可以保持在固定數(shù)值,本研究中為-0.1V,DNA保持在直立靜止狀態(tài)。該狀態(tài)下,由于結合事件的發(fā)生,導致熒光基團周圍的生化,物理等環(huán)境的改變,熒光基團的信號發(fā)生改變,這種改變不受所結合的分子大小的影響,而是受結合位點周圍化學環(huán)境的影響,因此主要依賴于互作的類型。

Table 1 DNA納米桿構成序列
DNA按照Table 1中的序列進行合成。cNL-B48和NL-W48-B48-G1購于Dynamic Biosensors GmbH,寡核苷酸p-cNL-B48, n, n*o, 和 o*p* (見Table 1) 購于Biomers.net. p-cNL-B48寡核苷酸鏈可以部分的與固定在芯片表面的NLB-48核酸鏈互補。攜帶有氨基基團的寡核苷酸鏈(p-cNL-B48, n*o, o*p*)與PeB肽進行交聯(lián)并進行純化;隨后,攜帶PeB肽的寡核苷酸鏈折疊成四臂結構,請見Figure 2。在進行動力學檢測之前,肽與寡核苷酸的耦合效率可以通過非變性聚丙烯酰胺凝膠電泳進行質量評估。該遞呈肽的DNA結構,在未與肽結合時分子量為43kDa,與三肽結合后的分子量為49kDa.
Figure 2 寡核苷酸-三肽偶合結構
分子互作檢測通過DRX2儀器(Dynamic Biosensors GmbH, Martinsried, Germany)進行。在本測量中,使用的生物芯片序列號為MPC-48-1-R1-S 或MPC2-48-2-G1R1-S(Dynamic Biosensors GmbH)。測量實驗流程通過switchBUILD軟件實現(xiàn),并通過switchCONTROL軟件逐步實行(軟件由Dynamic Biosensors GmbH提供)。芯片上每一個微流控通道在正式檢測前,需要使用含有硫醇基的鈍化溶液進行處理,然后進行芯片質量檢測,以保證芯片在良好的狀態(tài)下檢測到最大強度的熒光信號。DNA鏈以500nM的濃度與芯片進行雜交,雜交時間為320s,該互作動力學檢測在靜止模式下進行。底物的分析濃度范圍為10-40ug/ml。對于結合過程,底物上樣體積為50ul,流速為1ul/min,結合時間為50min; 對于解離過程,流速為3ul/min,解離時間為13.3分鐘。
在三明治模式的動力學檢測中,使用的是NL-W48-B48-G1寡核苷酸鏈,其部分與cNL-B48互補。該寡核苷酸鏈攜帶有綠色熒光基團。在檢測之前,DNA鏈(NL-W48-B48-G1 和DNA 納米結構ss1/2/3PeB)進行雜交,使得DNA納米結構標記上綠色熒光,用于后續(xù)檢測。兩條互補寡核苷酸鏈以1:1的比例混合,避光室溫孵育1小時。三明治檢測模式是以ss2PeB做為配體,將病毒X31進行捕獲,然后以肽-DNA 結構ss1/2/3PeB-NL-W48-B48-G1做為底物進行上樣分析其與病毒結合的動力學。該測量在swithcSENCE靜止模式下進行。
相互作用檢測的基礎為與芯片耦合的攜帶熒光基團的DNA寡核苷酸鏈(NL-B48)以及與其互補配對的攜帶有受體肽的寡核苷酸鏈。病毒顆粒在該檢測中,做為底物進行上樣分析。DNA之間雜交形成納米結構是在動力學模式(dynamic mode)下進行(請見Figure 3),病毒顆粒的結合是在靜止模式下進行(static mode)。熒光基團信號的變化,表征結合事件的發(fā)生。DNA鏈雜交后,檢測將轉為靜止模式,DNA-肽結構處于直立靜止狀態(tài)。本檢測中,互補配對的第二條DNA寡核苷酸鏈具有四個核苷酸臂,其中之一部分與固定在芯片上的NL-B48單核苷酸鏈進行互補,其余三條臂分別攜帶一個肽分子PeB。在具體實驗中,可靈活設計攜帶有單個,二個,三個或不攜帶肽分子的DNA結構。Figure 3b表示的是cNLB48以及ss3PeB和固定在芯片上的NLB-48雜交的示意圖。雜交的過程,提供的是交替變換的電壓,在互補配對鏈結合之前,單鏈DNA的運動是比較微弱的,可能由于單鏈結構的靈活性,使得熒光基團與芯片表面的距離比較接近,熒光信號變化幅度較低。一旦與互補鏈配對,請見Figure 3, 雙鏈DNA的移動幅度大大增加,熒光信號變化的幅度隨之提升。從Figure 3可以得知,相比于未攜帶肽分子的互補配對鏈, ss3PeB與NL-B48雜交的效率更高,這可能是由于大分子擴散速率慢,且DNA雙鏈更長,攜帶更多的負電荷。
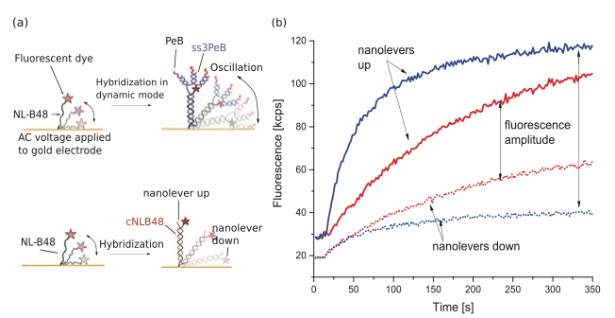
Figure 3 芯片雜交信號檢測
芯片雜交完成后,病毒顆粒做為底物進行上樣,與肽分子進行結合。請見Figure 4。數(shù)據(jù)以ss2PeB與病毒的結合進行展示。在結合過程中,保持1ul/min的低液流速率,以保證反應不受快速擴散的影響。因為DNA納米桿的長度大約為20nm,圓形病毒顆粒的平均直徑大約為120nm,桿狀病毒顆粒的長度約為300nm。因此單個病毒可能與一個以上的DNA納米桿單位進行結合。

Figure 4 病毒顆粒與ss2PeB結合示意圖
Figure 5展示了不同濃度的X31病毒顆粒和ss2PeB結合的動力學。X31病毒顆粒經(jīng)液流注入系統(tǒng)后,即可觀察到濃度依賴的熒光信號減少的發(fā)生。在每一次測量后,芯片都需要再生,然后重新進行DNA鏈的雜交。經(jīng)實驗觀察發(fā)現(xiàn),在極限的750s解離時間內(nèi),病毒顆粒仍舊穩(wěn)定的結合在DNA納米桿結構上。從已有的報道可知,病毒蛋白與其受體結合的親和性在uM級,這與該實驗中觀測到的解離結果不符。這可能是由于在該研究中,病毒顆粒與受體的結合是多價模式,導致了結合的avidity效應的發(fā)生,結合更加的穩(wěn)定。因此,這種方法使得對真實的親和性的檢測受到限制。做為陰性對照,ss0PeB(DNA鏈未與肽分子偶聯(lián))用于檢測病毒顆粒的非特異性結合。結果表明,病毒顆粒與肽的結合是特異性的。
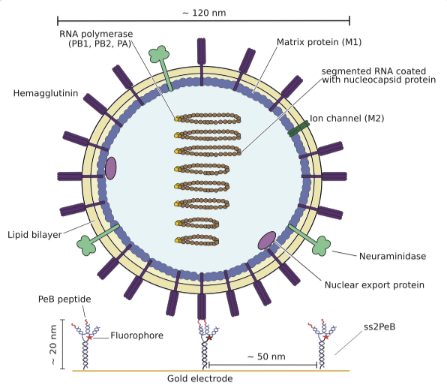
Figure 5 X31病毒顆粒與ss2PeB結合動力學
該實驗設計是將病毒顆粒做為生物材料,固定在芯片表面,目的是為了檢測到受體肽與其結合的解離常數(shù)及親和性。在本研究中,ss2PeB與芯片進行雜交,形成雙鏈DNA納米桿,經(jīng)由DNA鏈被標記成紅色熒光;隨后,X31病毒顆粒被ss2PeB捕獲。在上述實驗中發(fā)現(xiàn),在整個過程中,病毒顆粒與肽的結合非常牢固,無解離的發(fā)生,因此可將該病毒顆粒做為固定的配體,進行后續(xù)的二次動力學結合檢測。可將標記綠色熒光基團的肽-DNA鏈做為分析底物,與固定結合的病毒進行結合。
Figure 6展示了該實驗設計的原理圖。ss2PeB-G1與X31的結合,導致了綠色熒光通道信號的逐步增強。對于結合的起始點,該模式中也有了明顯的信號改變。總的來說,無論是結合還是解離,該模式下的熒光信號改變都非常明顯,能夠讓研究人員更加準確的判斷結合的起始和解離的過程。通過該三明治模式,可以對肽與病毒結合的解離動力學進行研究。在本研究中,經(jīng)測量,兩者的結合常數(shù)為 kon = (1.8 ± 0.8) × 10 5 M ?1 s?1 ,解離常數(shù)為 koff = (2.3 ± 0.2) × 10 ?3 s?1,親和性為KD = (12 ± 7) nM。未捕獲病毒的DNA納米桿做為對照,用以排除非特異性結合。除了ss2PeB,單價肽ss1PeB-G1和三價肽ss3PeB-G1也進行了相應的檢測,三種復合物得到了較為相似的結合和解離動力學常數(shù)。ss1PeB-G1, KD = (12 ± 9) nM ,ss3PeB-G1, KD=(8 ± 7) nM.
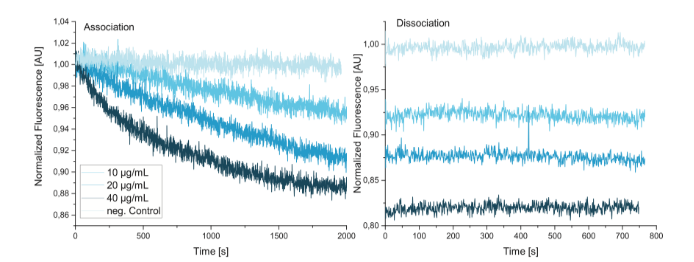
Figure 6 三明治模式檢測病毒與肽結合的動力學
本研究證實了DNA納米結構可以用于病毒-肽的互作動力學分析。利用switchSENCE技術,將PeB與DNA單鏈進行耦合,并與A型流感病毒X31進行結合,該結合信號隨病毒濃度的變化而變化。但由于兩者結合中的多價效應存在,無法通過該模式對解離動力學進行檢測。在三明治設計模型中,我們可以實現(xiàn)同時對結合和解離動力學進行分析,進而得到兩者互作的親和性。在這種模式下,兩者之間的多價效應對動力學檢測的影響較小。后續(xù)對于該技術更深入的探索研究,可以對DNA納米骨架進行優(yōu)化(比如單臂的長度,中心結點的靈活度等),以最大程度的減小單價遞呈模塊對結合動力學的影響。目前,由于測量誤差太大還不能夠區(qū)分單價結合的親和性常數(shù),需要更長的解離時間以達到檢測的目的。總的來說,進行病毒-肽之間的互作動力學分析,在傳統(tǒng)的SPR技術中遇到了一定的阻礙。由于病毒顆粒結構和蛋白表達的豐度,需要考慮受體的密度,物質的流動速率以及樣本制備等方面。在switchSENCE技術中,受體的密度可以通過單鏈DNA納米桿的數(shù)量進行控制。實驗后芯片再生的過程,也會影響到受體的密度,減少了芯片上高質量納米桿的數(shù)量,這是在實驗的重復性驗證方面需要進行考慮的問題;對于物質轉運的限制,可以通過減少芯片上受體的數(shù)量以及增加流速解決。然而,芯片上受體數(shù)量的減少的同時,還需要考慮儀器整體的信噪比。對于多價結合的動力學曲線,單指數(shù)模型無法準確的擬合,需要更多的擬合模型應對復雜的互作動力學結果。總的來說,switchSENCE技術可以廣泛的應用到肽的優(yōu)化,病毒與不同受體,包括核酸適配體,肽,抗體或者蛋白等分子結合的定量和定性分析,并且該技術可以更方便的用于單價和多價結合動力學分析。




