2016年,世界衛(wèi)生組織(WHO)將多替拉韋(DTG)列為HIV感染一線治療藥物,其高效的病毒抑制能力與良好的安全性迅速使其成為全球首選方案。然而,2018年博茨瓦納Tsepamo研究打破了這一樂觀局面——孕期暴露于DTG的女性,胎兒神經(jīng)管缺陷(NTD)風(fēng)險(xiǎn)較非DTG治療組升高9倍(0.94%vs.0.12%)[1],這一發(fā)現(xiàn)引發(fā)全球?qū)TG妊娠期安全性的高度關(guān)注。
NTD是全球最常見的出生缺陷之一,其發(fā)生與胚胎神經(jīng)管閉合異常密切相關(guān),而葉酸缺乏是明確的風(fēng)險(xiǎn)修飾因子——孕前3個(gè)月至孕期補(bǔ)充400 μg/天葉酸可降低50%-75%的NTD發(fā)生率[2,3]。值得注意的是,博茨瓦納等未強(qiáng)制實(shí)施葉酸強(qiáng)化食品政策的地區(qū),人群葉酸缺乏率超過20%,而DTG被證實(shí)可非競(jìng)爭(zhēng)性拮抗葉酸受體1(FOLR1),在臨床治療濃度(3-10 μM)下降低葉酸與受體結(jié)合效率達(dá)46%。這提示DTG的致畸性可能與葉酸水平存在交互作用,但傳統(tǒng)檢測(cè)技術(shù)因無法精準(zhǔn)量化低葉酸狀態(tài)下的代謝波動(dòng),導(dǎo)致“藥物-營養(yǎng)”協(xié)同效應(yīng)的機(jī)制研究停滯不前。
1.實(shí)驗(yàn)對(duì)象
實(shí)驗(yàn)對(duì)象為CD-1 品系孕鼠(Charles River Laboratories),適應(yīng)性喂養(yǎng) 4 周后分為兩組飲食:正常葉酸組(NF):3mg/kg 葉酸飲食(模擬人類推薦攝入量[3]);低葉酸組(LF):0.3mg/kg 葉酸飲食(模擬葉酸缺乏環(huán)境,葉酸含量?jī)H為正常組 10%)。
2.DTG暴露
胚胎期E6.5-E12.5(神經(jīng)管閉合關(guān)鍵期),通過飲水給予DTG:
對(duì)照組(0X):飲用純水;
治療劑量組(1X):3.5mg/L(人類等效劑量[4]);
超治療劑量組(5X/10X):17.5mg/L、35mg/L,模擬臨床過量暴露場(chǎng)景;
樣本量:每組20-24只孕鼠,足月(E18.5)剖宮取胎,共檢測(cè)1200+胎兒。
基于葉酸結(jié)合蛋白(FBP)的競(jìng)爭(zhēng)結(jié)合法,利用Dispendix I.DOT 非接觸式液體處理器構(gòu)建高靈敏度檢測(cè)體系[5]:
1. 探針陣列打印:在96孔板底部以2×2陣列形式打印50ng/mLFBP(Sigma-AldrichF0504),單孔反應(yīng)體積僅40μL(傳統(tǒng)方法需200μL),試劑消耗降低80%;
2. 標(biāo)準(zhǔn)曲線構(gòu)建:配置0.09375-6ng/mL葉酸標(biāo)準(zhǔn)品,結(jié)合葉酸-辣根過氧化物酶共軛探針(FA-HRP),通過化學(xué)發(fā)光底物(ThermoScientificSuperSignal)實(shí)現(xiàn)納克級(jí)精準(zhǔn)定量,檢測(cè)下限達(dá)0.05ng/mL;
3. 數(shù)據(jù)優(yōu)勢(shì):非接觸式分配避免交叉污染(污染率<0.01%),變異系數(shù)(CV)僅3.2%,較手動(dòng)移液(CV>15%)精度提升4倍,成功捕捉低葉酸組血清葉酸濃度波動(dòng)[6]。
1.大體觀察:記錄胚胎著床數(shù)、活胎數(shù)、死胎數(shù),計(jì)算植入后丟失率;
2.組織學(xué)分析:采用Wilson技術(shù)解剖軟組織結(jié)構(gòu),檢測(cè)神經(jīng)管缺陷(露腦畸形)、腭裂;
3.骨骼染色:阿爾新藍(lán)-茜素紅雙染法觀察頸椎/胸椎融合、肋骨畸形等骨骼異常[7]。
低葉酸+DTG組:3窩共4例胎兒出現(xiàn)露腦畸形(圖1A),發(fā)生率0.415%,顯著高于歷史對(duì)照(0.01%),F(xiàn)isher精確檢驗(yàn)p=0.0007(表2);
正常葉酸組:無論DTG劑量(1X/5X/10X),均未觀察到NTD,證實(shí)充足葉酸可完全屏蔽DTG的致畸風(fēng)險(xiǎn)(表1)。I.DOT關(guān)鍵數(shù)據(jù):低葉酸組血清葉酸均值5.73±0.97ng/mL,雖未達(dá)貧血閾值,但變異顯著升高(p=0.0483),提示個(gè)體間葉酸利用差異放大DTG風(fēng)險(xiǎn)(表1)。
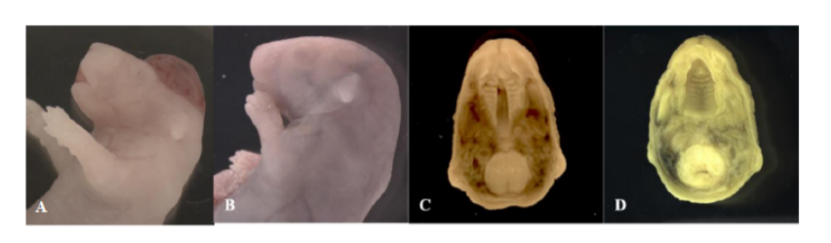
圖1. 觀察大體和內(nèi)部表型的形態(tài)學(xué)。具有A)露腦神經(jīng)管缺陷、B)正常頭部形態(tài)、C)腭裂和D)正常腭形態(tài)的CD 1 E18.5小鼠的代表性圖像。
表1. 具有平均值和標(biāo)準(zhǔn)差的妊娠結(jié)局的總結(jié)
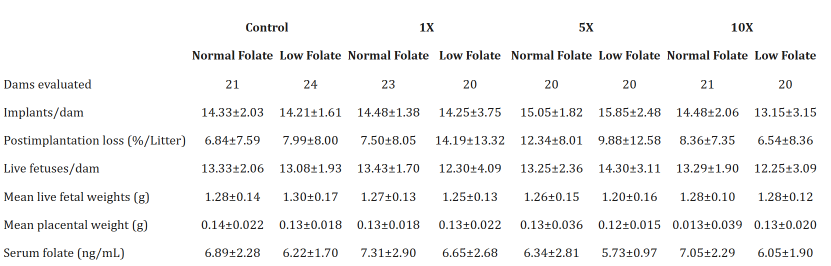
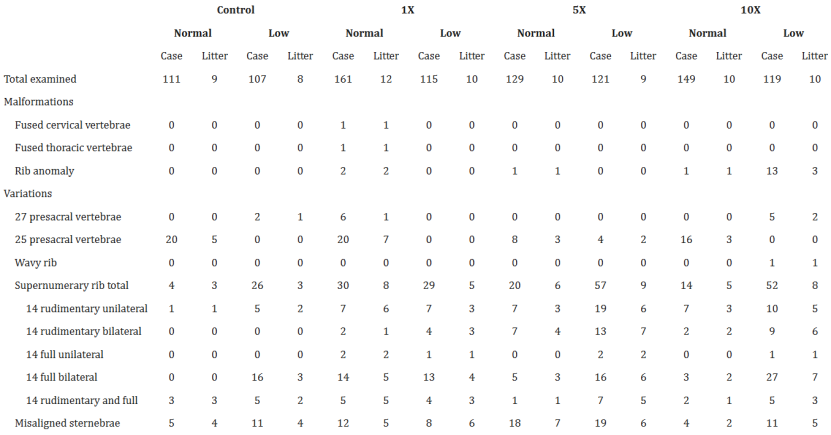
腭裂:正常/低葉酸組共3窩出現(xiàn)腭裂(圖2C),與DTG暴露顯著相關(guān)(p=0.0167),提示DTG對(duì)顱神經(jīng)嵴細(xì)胞遷移的干擾不依賴葉酸水平(表2);
骨骼異常:低葉酸+10XDTG組肋骨畸形率達(dá)13%(3窩17例),主要表現(xiàn)為肋骨融合/多余肋骨,而正常葉酸組僅2%(2窩4例),I.DOT檢測(cè)顯示高劑量DTG下葉酸受體抑制率從30%升至55%(表3)。
表2. 大體和軟組織畸形總結(jié)
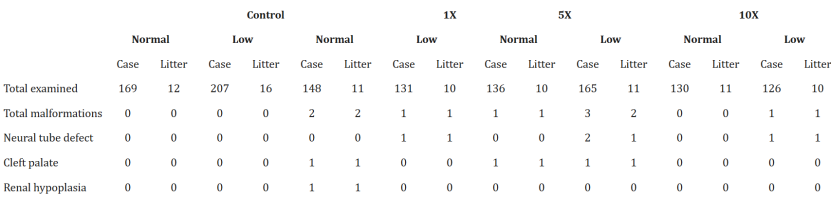
表3. 骨骼畸形和變異總結(jié)
各組母鼠體重增長(zhǎng)、血常規(guī)、肝腎功能均無顯著差異,證實(shí) DTG 毒性主要靶向胚胎發(fā)育,而非母體健康(圖2,表1)

圖2.整個(gè)妊娠期間母體平均體重增加。正常喂養(yǎng)的母鼠(3.0毫克/千克,實(shí)線)和低(0.3mg/kg,虛線)葉酸飲食用0X(正常飲食n=21,低飲食n=24,藍(lán)色),1XHED(3.5毫克/升)(正常飼料n=23,低水平飼料n=20,綠色),5XHED(17.5mg/L)(正常飲食n=20,低飲食n=20,黃色)或10XHED(35mg/L)(正常飲食n=21,低飲食n=20,橙色)DTG從E6.5至E12.5。每隔一天對(duì)母鼠稱重。條表示標(biāo)準(zhǔn)偏差。
本研究通過I.DOT檢測(cè)發(fā)現(xiàn),低葉酸環(huán)境中DTG使胚胎葉酸攝取效率下降46%,導(dǎo)致神經(jīng)管閉合關(guān)鍵基因如Pax3、Shh表達(dá)異常,最終引發(fā)露腦畸形。正常葉酸組血清葉酸均值6.89±2.28ng/mL,足以補(bǔ)償DTG的受體拮抗作用,而低葉酸組波動(dòng)幅度達(dá)2.6ng/mL,為正常組1.3倍,使部分胚胎落入“葉酸匱乏閾值”,激活致畸通路。
臨床對(duì)照上,博茨瓦納未實(shí)施葉酸強(qiáng)化,2018年DTG相關(guān)NTD風(fēng)險(xiǎn)0.94%,隨著葉酸補(bǔ)充推薦,2022年風(fēng)險(xiǎn)降至0.19%,與實(shí)驗(yàn)中“低葉酸組風(fēng)險(xiǎn)隨葉酸水平升高而下降”一致 [8,9];葉酸強(qiáng)化國家如美國,人群血清葉酸均值提升35%,使用DTG時(shí)NTD發(fā)生率仍維持0.09%基線水平,驗(yàn)證“葉酸充足可阻斷DTG致畸”。技術(shù)價(jià)值上,I.DOT僅需5μL臨床樣本即可檢測(cè),解決傳統(tǒng)方法樣本耗竭問題,且憑借高通量(100+樣本/天)與低CV(<5%),成功捕捉低葉酸組0.415%的NTD發(fā)生率,為罕見致畸事件研究提供可靠工具。
在技術(shù)價(jià)值層面,I.DOT技術(shù)憑借微量樣本精準(zhǔn)檢測(cè)能力(僅需5μL血清即可完成檢測(cè)),有效解決了傳統(tǒng)方法中珍貴臨床樣本耗竭的難題,尤其適用于孕婦血清等稀缺樣本的葉酸代謝分析;其高通量(100+樣本/天)與低變異系數(shù)(CV<5%)特性,成功捕捉到低葉酸組0.415%的罕見神經(jīng)管缺陷(NTD)發(fā)生率——這一精度遠(yuǎn)超傳統(tǒng)方法(易因誤差漏檢),為發(fā)育毒理學(xué)研究中低概率致畸事件的量化分析提供了可靠工具。
1. Zash R, Makhema J, Shapiro RL. Neural-Tube Defects with Dolutegravir Treatment from the Time of Conception. N Engl J Med 2018; 379(10):979–981.
2. Blom HJ, Shaw GM, den Heijer M, Finnell RH. Neural tube defects and folate: case far from closed. Nat Rev Neurosci 2006; 7(9):724–731.
3. CDC. Recommendations for the use of folic acid to reduce the number of cases of spina bifida and other neural tube defects. MMWR Recomm Rep 1992; 41(RR-14):1–7.
4. Eadon MT, Zhang H, Skaar TC, Hato T, Dagher PC, Gupta SK, et al. A two-week regimen of high-dose integrase inhibitors does not cause nephrotoxicity in mice. Antivir Chem Chemother 2015; 24(2):72–76.
5. Cabrera RM, Shaw GM, Ballard JL, Carmichael SL, Yang W, Lammer EJ, et al. Autoantibodies to folate receptor during pregnancy and neural tube defect risk. J Reprod Immunol 2008; 79(1):85–92.
6. Cabrera RM, Souder JP, Steele JW, Yeo L, Tukeman G, Gorelick DA, et al. The antagonism of folate receptor by dolutegravir: developmental toxicity reduction by supplemental folic acid. AIDS 2019; 33(13):1967–1976.
7. Massa V, Cabrera RM, Menegola E, Giavini E, Finnell RH. Valproic acid-induced skeletal malformations: associated gene expression cascades. Pharmacogenet Genomics 2005; 15(11):787–800.
8. Zash R, Holmes L, Diseko M, Jacobson DL, Brummel S, Mayondi G, et al. Neural-Tube Defects and Antiretroviral Treatment Regimens in Botswana. N Engl J Med 2019; 381(9):827–840
9. Zash R, Holmes L, Diseko M, Jacobson D, Mayondi G, J M, et al. Update on neural tube defects with antiretroviral exposure in the Tsepamo Study, Botswana. In: AIDS. Montreal; 2022.




