我們的研究表明,用于細胞系開發的 C.BIRD? 微生物反應器能夠改善 96 孔培養的哺乳動物細胞生長情況,并且在細胞生長曲線和蛋白質產量方面與搖瓶培養數據極為相似。
傳統的細胞系開發(CLD)流程由于早期和后期開發過程中產生的細胞系特征不一致,需要花費大量時間才能找到最優克隆。C.BIRD 系統是一種新的細胞培養創新技術,通過減少兩個階段之間的細胞特征差異,并在 CLD 流程的早期提供最佳懸浮培養條件,解決了這一問題。在本研究中,我們使用 C.BIRD 系統和不使用 C.BIRD 系統培養中國倉鼠卵巢(CHO)細胞系,并比較了生成的細胞特征與在搖瓶培養環境中培養的細胞特征之間的差異。結果表明,C.BIRD 提高了活細胞/總細胞生長和細胞活力,并且與大規模搖瓶培養具有出色的可比性。此外,細胞倍增時間和相對蛋白質產量都有顯著提高,且在統計學上沒有差異。
生物制藥行業正在呼吁加快細胞系開發(CLD)流程,以便新生物制品能夠更快獲得監管部門的批準。然而,傳統的 CLD 流程可能需要數月甚至長達一年的時間才能確定最佳的細胞克隆。如此漫長的周期的一個原因是在 CLD 的早期階段選擇合適的克隆時遇到了困難。早期細胞數量較少,采用靜態培養。后期則會轉變為懸浮培養,以擴大細胞產品的產量。從靜態培養到懸浮培養的轉變會產生不同的細胞系特征(生長速率、滴度、代謝特征等)。這阻礙了在早期 CLD 過程中正確細胞克隆的識別。因此,需要大量的克隆進行測試,這增加了 CLD 的成本和所需時間。為了加快開發進程,整個過程中保持一致的細胞培養條件至關重要,以便在 CLD 過程中早期識別具有正確且可持續特征的細胞克隆。
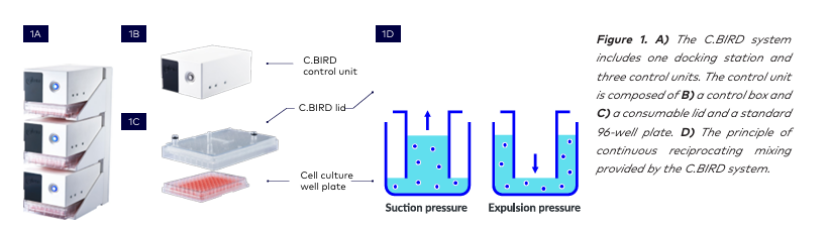
高通量技術正越來越多地應用于細胞培養實驗(CLD)流程中。這些技術能在小規模的培養皿/試管中提供懸浮培養環境,并增強氧氣供應。在本研究中,我們展示了一種新的系統,即 C.BIRD 微生物反應器系統,它能夠在標準的 96 孔板中實現早期階段的懸浮細胞培養。C.BIRD 系統結構緊湊,易于放入標準培養箱中。它有一個對接站,可容納三套 C.BIRD 系統(圖 1A)。該系統由兩部分組成:頂部的自主控制箱(圖 1B)和帶有 96 個圓柱形管的消耗性 C.BIRD 蓋子(圖 1C)。C.BIRD 蓋子上的管子提供了 96/24 個液流通道,使得在標準細胞培養板中的每個孔都能吸入和排出空氣。這些通道與氣動連接,并由控制系統驅動,從而在 96 孔板中每個孔內實現 150 - 200 μL 工作體積的連續往復混合(圖 1D)。有了 C.BIRD,就可以在 96 孔板中實現體積小至 150 - 200 μL 的細胞培養規模的三維懸浮培養環境。C.BIRD 可以模擬振蕩器的作用。在良好的細胞培養環境以及從早期階段就加速細胞系分化(CLD)進程的情況下,從而為細胞更好地生長以及克隆特征的可預測性提供了新的可能性。
本對比實驗的設計如圖 2A 所示。我們研究了 mAb CHO-K1 和 CHO-S 細胞系在兩種不同規模(從 200 μL 96 孔板到 30 mL 攪拌瓶)下的每日細胞生長、倍增時間以及蛋白質產量,并比較了 96 孔板中的兩種不同培養條件——標準靜態培養和 C.BIRD 懸浮培養。我們的結果表明,采用懸浮培養的 C.BIRD 系統表現出優于靜態培養的優越性能,并且與攪拌瓶培養表現出相當的細胞系特征。更重要的是,C.BIRD 懸浮培養的生長曲線與攪拌瓶培養的晚期階段曲線非常相似,這是早期細胞克隆選擇和可預測性的一個重要特征。
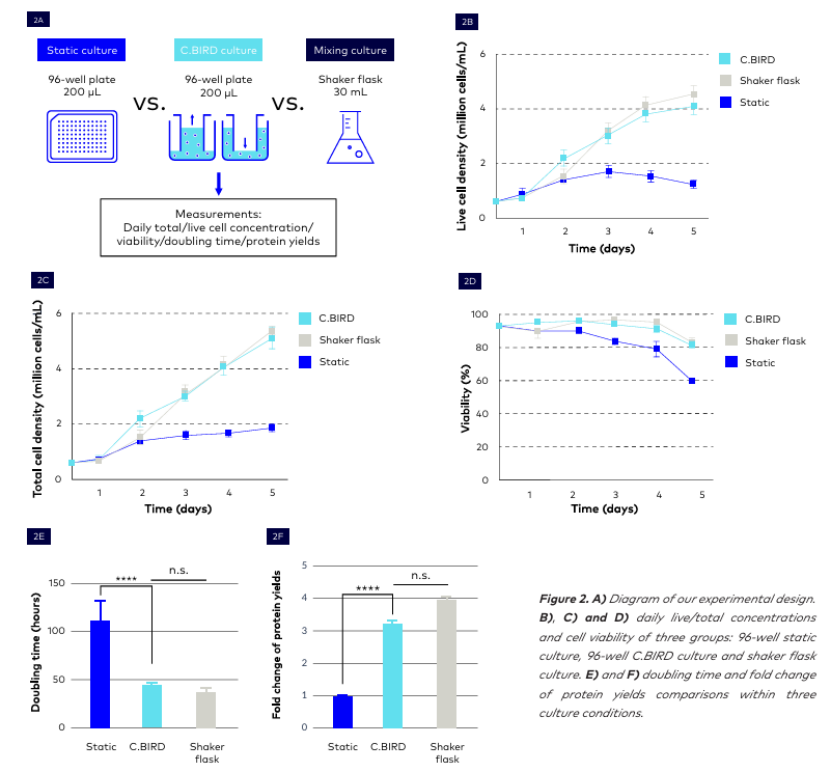
在培養細胞五天后,C.BIRD 懸浮培養和搖瓶培養分別實現了每毫升 4.4×10^6 個細胞和 4.9×10^6 個細胞的活細胞密度,而靜態培養在第五天僅達到 1.2×10^6 個細胞/毫升(圖 2B)。
細胞密度的 3.5 倍差異表明,與靜態培養相比,C.BIRD 懸浮培養為最大化細胞生長提供了更理想的生長條件。
同樣,每個條件下的總細胞密度也呈現出相同的趨勢。96 孔 C.BIRD 培養和搖瓶培養分別實現了每毫升 5.2×10^6 個細胞和 5.7×10^6 個細胞的總細胞密度,而靜態培養在第五天僅達到 2.0×10^6 個細胞/毫升(圖 2C)。這些數據提供了強有力的證據,表明在 96 孔規模下,C.BIRD 培養提供了最理想的細胞生長條件。對三種培養條件的可行性比較表明C.BIRD 培養法的表現優于靜態培養法,其細胞存活率保持較高水平,與搖瓶培養條件相當。C.BIRD 培養法和搖瓶培養法在第 5 天時細胞存活率仍保持較高水平,分別為 84.3% 和 86.3%。然而,靜態培養法在第 5 天時細胞存活率降至 60.3%(圖 2D)。
且與靜態培養相比,C.BIRD 培養法顯著縮短了細胞的倍增時間,從 114 小時縮短至 38.5 小時。在搖瓶培養(35.1 小時)和 C.BIRD 培養(38.5 小時)之間,細胞的分裂時間沒有顯著差異。結果表明,96 孔 C.BIRD 具有高性能水平,并且能夠在早期提供搖瓶生長條件(圖 2E)。
最后,每種培養條件下的細胞系蛋白質產量呈現出相同的模式。與靜態培養相比,C.BIRD 培養下的蛋白質產量的倍數變化顯著更高(高 0.7 倍),而 C.BIRD 和搖瓶之間的倍數變化沒有顯著差異(2.86 倍對 3.21 倍),如圖 2F 所示。
在第 5 天,C.BIRD 懸浮培養達到活細胞密度 5.54×10^6 個/mL,搖瓶培養達到 7.07×10^6 個/mL,而靜態培養僅達到 1.68×10^6 個/mL。(圖 3A)。就總細胞密度而言,96 孔 C.BIRD 培養達到 6.48×10^6 個/mL,搖瓶培養為 1.2×10^6 個/mL,而靜態培養為 1.68×10^6 個/mL。(圖 3B)
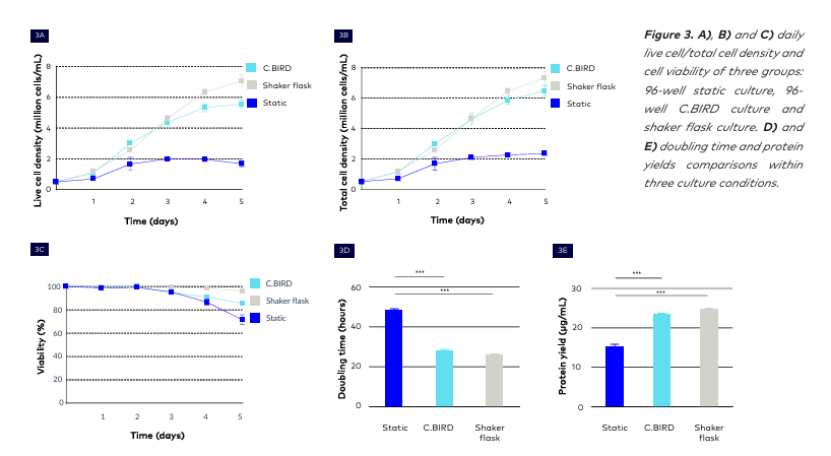
C.BIRD 懸浮培養組和靜態培養組之間細胞密度約有 3 倍的差異,這進一步證實了 C.BIRD 懸浮培養組提供了比靜態培養更好的生長條件。
第 5 天的細胞活力比較顯示,C.BIRD 培養組優于靜態培養組,細胞活力保持較高水平。C.BIRD 培養組的細胞活力維持在 86%,與搖瓶培養組的 99% 相當。然而,靜態培養組的細胞活力在第 72 小時下降到 72%(圖 3C)。
與靜態培養組相比,C.BIRD 在第 4 天顯著縮短了細胞倍增時間,從 48.6 小時縮短至 28.1 小時,而搖瓶培養組的倍增時間為 26.2 小時。這些結果證實了 96 孔 C.BIRD 的高表現及其在早期階段提供搖瓶培養條件的能力(圖 3D)。
最后,每種培養條件下的細胞系蛋白質產量都呈現出相同的模式,驗證了我們的陳述。在第 5 天,C.BIRD 懸浮培養組的 CHO-S 細胞產生了 23.52 μg/mL 的蛋白質。在搖瓶培養中,細胞產生的單克隆抗體(mAb)濃度為 24.68 μg/mL,而使用小鼠腹腔細胞培養時,細胞培養液中單克隆抗體的濃度為 100 μg/mL。C.BIRD 的蛋白質產量也顯著高于靜態培養(15.08 μg/mL),高出 1.5 倍(圖 3E)。
本研究表明,用于細胞系開發的 C.BIRD 微生物反應器在以下三個方面顯著改善了 96 孔培養環境中的哺乳動物細胞生長:1)細胞生長;2)倍增時間;3)蛋白質產量
我們還證明了 C.BIRD 系統在細胞生長曲線和蛋白質產量方面與搖瓶培養方式高度相似。總之,C.BIRD 系統能夠使細胞更早地過渡到懸浮細胞培養方式,并且在標準的 96 孔板中具有更高的細胞生長速率,這有可能為后續的連續流分離(CLD)過程提供更好的向大規模搖瓶/生物反應器條件的轉化。




