傳統藥物開發中,化合物庫合成與生物篩選面臨“高成本、低通量、長周期”的三重挑戰,單藥研發成本超20億美元,且96孔板等傳統平臺難以滿足微量樣本的高效利用需求[1,2]。德國卡爾斯魯厄理工學院團隊聯合I.DOT非接觸式液滴分配技術,推出光控釋放液滴微陣列(DMA)平臺,首次實現從納摩爾級固相合成到活細胞篩選的全流程集成。該平臺通過I.DOT精準操控100nL級液滴反應單元,結合UV觸發化合物釋放機制,將試劑消耗降低至傳統方法的1/1000,為高通量藥物發現開辟全新路徑。
納米多孔聚合物涂層:在玻璃基底制備12μm厚HEMA-EDMA聚合物層,通過硫醇-炔點擊化學構建親水(接觸角4.4°)/超疏水(接觸角170°)圖案,形成3mm圓形(5μL)或1mm方形(100nL)液滴陣列(圖1)。I.DOT技術通過氣壓脈沖(75-300mbar?ms)實現非接觸式液滴生成,體積誤差<1%,單細胞接種成功率>95%。
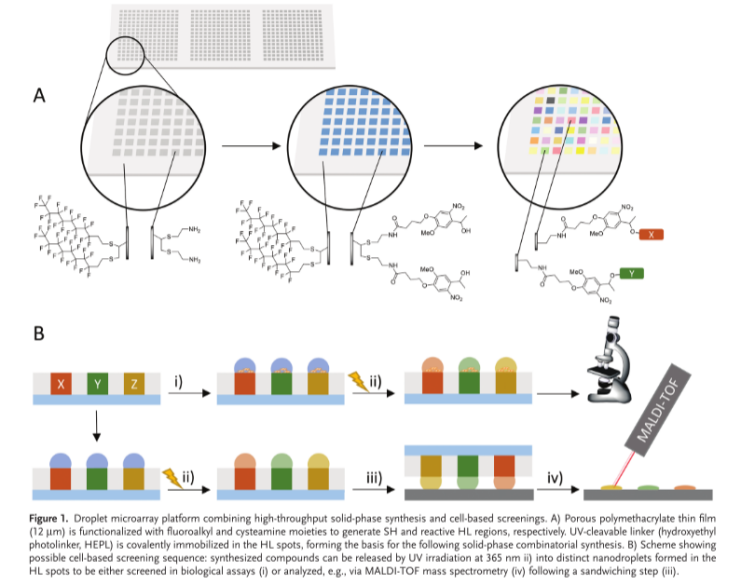
圖1. 液滴微陣列平臺結合高通量固相合成和基于細胞的篩選。A)多孔聚甲基丙烯酸酯薄膜(12 μm)用氟烷基和半胱胺部分官能化以分別產生SH和反應性HL區域。UV-可切割的連接體(羥乙基光連接體,HEPL)共價固定在HL斑點中,形成后續固相組合合成的基礎。B)顯示可能的基于細胞的篩選順序的方案:合成的化合物可以通過在365 nm下的UV照射ii)釋放到在HL斑點中形成的不同納米液滴中,以在生物測定(i)中篩選或分析,例如,通過MALDI-TOF質譜法(iv),隨后進行純化步驟
UV 可裂解連接劑錨定:將羥基乙基光連接劑(HEPL)通過酯鍵固定于親水斑點,其硝基基團在 365 nm UV 光下可快速還原為亞硝基,釋放共價結合的化合物(圖2)。
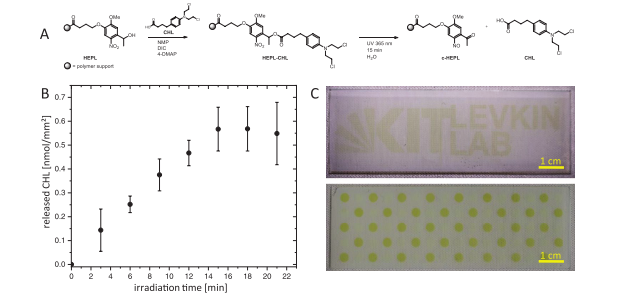
圖2. A)將CHL附著到HEPL上,隨后在UV-照射下釋放,在表面上留下裂解的光致連接物(c-HEPL)。B)通過對不同照射時間后的溶液進行光譜分析,確定了作為模型藥物的CHL從表面釋放到5μL液滴中的UV觸發動力學。每個數據點是三次實驗的平均值。誤差線表示標準差。C)通過UV光對HEPL裂解的空間控制。在接頭裂解期間,顯黃色。制備液滴微陣列,并在通過光掩模照射之前在所有HL斑點中用HEPL修飾。頂部圖案:2688個正方形斑點,邊長500 μm,邊框250 μm。使用“KIT Levkin Lab”徽標作為倒置光掩模。底部圖案:以棋盤圖案照射80個直徑為3 mm的圓點。UV連接體HEPL可完全控制化合物的空間釋放。
組合化學高通量合成:利用I.DOT的高通量分配能力,在1 mm方形斑點中依次分配30 nL胺溶液、35 nL羧酸溶液和40 nL異氰化物溶液(0.5MGBL體系),通過非接觸式打印避免交叉污染。5種表面錨定氨基酸、3種異氰化物、7種羧酸和8種羰基化合物組合,理論生成840種雙酰胺產物(圖3)。
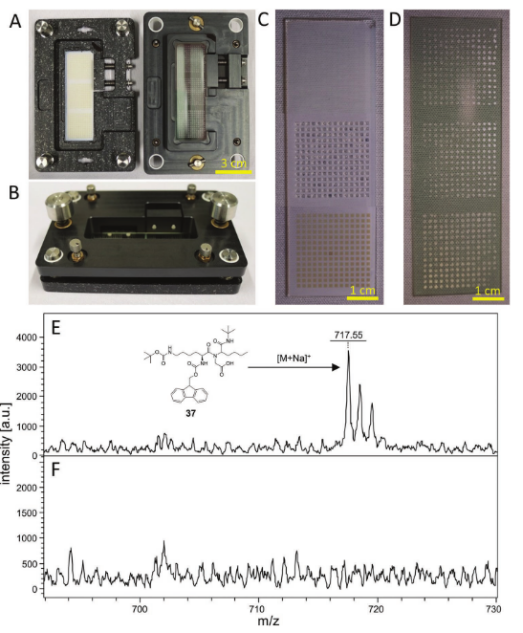
圖3. Ugi四組分反應的示意圖,具有表面錨定的胺(1-5)、羧酸(9-15)、醛或酮(16-23)和異氰化物(6-8)以及形成的雙酰胺(產物24-36)的可變條目。底部:固相化學的詳細表示。連接到聚合物層的每個4-戊炔酸充當分支點并帶有兩個連接分子,有效地使反應位點的總數加倍。
自動化流程整合:I.DOT與MALDI-TOF聯用,通過三明治轉移技術將液滴產物復制到ITO玻片,實現高通量質譜表征(圖4)。
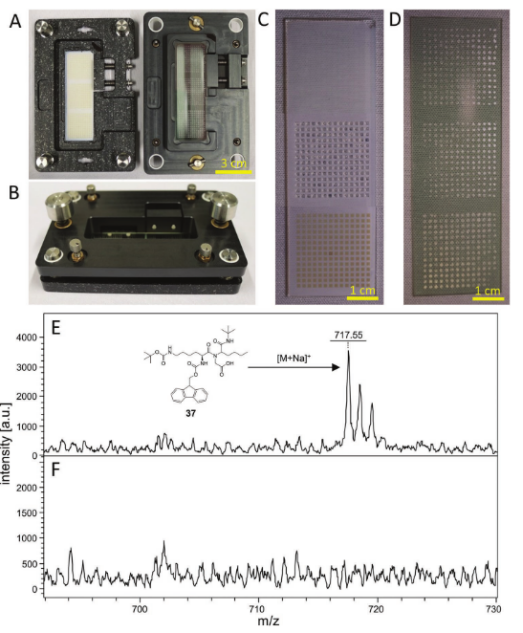
圖4.將微滴微陣列復制到ITO載玻片上用于MALDI-TOFMS測量的過程。A)定位裝置有助于將兩個載玻片彼此對準。左側是具有經照射的液滴微陣列的底部部分,而右側是具有ITO載玻片(已經壓印有基質)的頂部部分。B)封閉式密封裝置。兩側的兩個連接器將兩半拉在一起,而距離由四個螺釘控制。降低頂部,直到所有液滴接觸ITO載玻片。C)干燥DMA(14×141 mm HL點,頂部)、每個點中具有100 nL水的DMA(中間)和UV照射后的干燥陣列(底部)的合并照片。D)復制液滴中含有基質混合物(CHCA/DHB)的液滴微陣列并真空干燥后的ITO載玻片。E)作為鈉加合物的化合物37的MALDI-TOF光譜([M+Na]+,檢測:717.55m/z,計算:717.38u)和F)基質背景。首先通過UV照射將化合物切割成不同的液滴,然后向每個斑點中加入100 nL CHCA和DHB基質在10% ACN/水(含有5×10?3M HCl)中的飽和溶液,并將DMA載玻片固定在ITO載玻片上以復制陣列。將ITO載玻片真空干燥并通過MALDI-MS分析。
I.DOT 細胞接種與活性檢測:以氯ambucil(CHL)為模型藥,I.DOT將CHO-K1細胞(1×10?cells/mL)精準接種至DMA斑點,UV照射(2.5 mW/cm2,15 min)觸發CHL釋放,通過Calcein-AM/PI染色評估細胞活力。
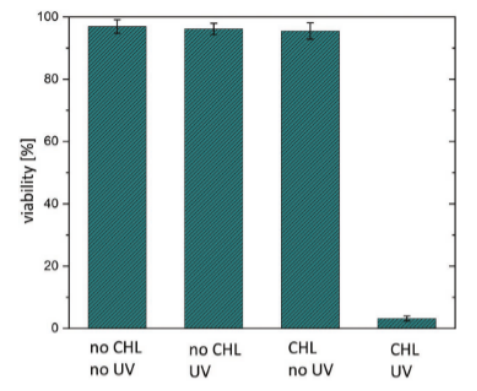
圖5. 將CHO-K1細胞接種在DMA上,并在孵育24小時后,通過鈣黃綠素AM/PI染色不同處理的表面來測定其活力。活力不受紫外光或固定化CHL的存在下。細胞活力僅在用附著的CHL照射表面后降低,這導致藥物釋放到液滴中。每個柱代表同一實驗重復三次的平均值。誤差線表示標準差。
時空精準調控:I.DOT配合光掩模實現區域選擇性釋放,如“KIT” logo圖案化釋放驗證空間控制精度(圖2C);CHL釋放動力學顯示,15分鐘內可達最大濃度954 μM(圖2B),滿足細胞篩選的劑量需求。
細胞水平驗證:UV觸發CHL釋放后,CHO-K1細胞存活率從97%降至3%,而未照射組或無藥組存活率無顯著變化,證明I.DOT構建的微環境可精準模擬藥物-細胞互作。
微型化優勢:1 mm方形斑點較3 mm圓形斑點,單位面積反應密度提升7.5倍(30spots/cm2),單玻片可構建588種化合物庫,較96孔板通量提升6倍。I.DOT的非接觸式分配使試劑消耗從20 μL/樣本降至100nL/樣本,成本降低99%。
產物多樣性與純度:13種代表性產物純度21%-91%(LC-MS分析),MALDI-TOF驗證顯示I.DOT輔助合成的化合物結構一致性達95%以上。
I.DOT驅動的技術革新展現出顯著的核心技術價值,其非接觸式分配與DMA光控釋放結合,實現“合成-釋放-篩選”全流程自動化閉環,較傳統多平臺操作減少7次樣本轉移,誤差降低80%,且支持單日處理超1000樣本,單細胞cDNA回收率達85%,平衡了高通量與低耗需求。在轉化醫學應用中,可用于腫瘤藥敏個性化篩選,48小時內完成評估,周期縮短70%,還能精準控制信號分子濃度以維持胚胎干細胞多能性,未來將開發亞微米級斑點提升庫容量至10?級,并集成微流控灌注系統模擬體內藥代動力學。
1. J. A. DiMasi, H. G. Grabowski, R. W. Hansen, J. Health Econ. 2016, 47, 20.
2. H. E. Blackwell, Curr. Opin. Chem. Biol. 2006, 10, 203.




