傳統非病毒轉染效率低,而篩選增強劑需測試數千種化合物,依賴微孔板的高通量技術存在試劑消耗大(每實驗需20 μL)、成本高的瓶頸。德國卡爾斯魯厄理工學院團隊開發的液滴微陣列(DMA)平臺,結合I.DOT非接觸式納升級移液系統,首次實現20 nL級微量體系的高通量轉染篩選:單次篩選774種藥物,完成41796次實驗僅消耗0.84 mL細胞懸液和0.02 μmol藥物,試劑用量較384孔板減少2500倍,成功篩選出14種轉染增強劑,轉染效率提升2-5倍,為基因遞送研究和生物制藥生產提供突破性工具
采用7.5×2.5cm玻璃載玻片,表面圖案化為超疏水背景包圍的親水斑點(500 μm或1 mm邊長),形成588或2187個獨立反應單元,每個單元可容納20-100 nL液滴(圖1A)。
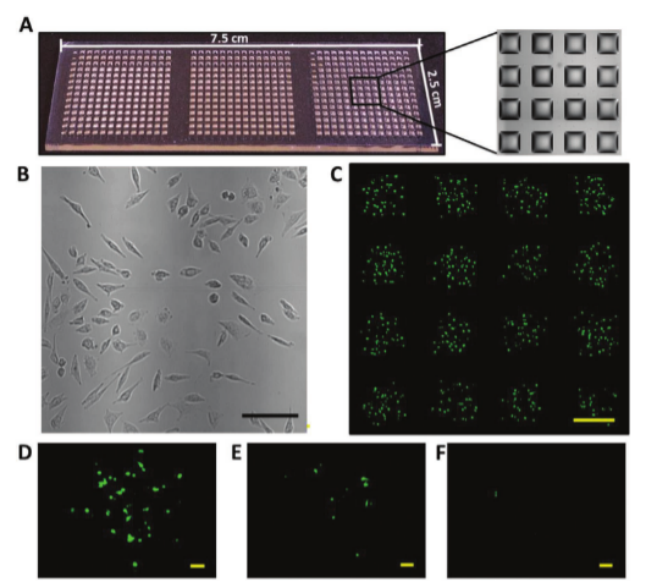
圖1. A)具有588個單獨微滴的1 mm(正方形邊長為1 mm)微滴微陣列(DMA)的代表性圖像。DMA載玻片的尺寸為7.5 ± 2.5 cm。B)明視野顯微鏡圖像,顯示孵育24小時后CHO-K1細胞的形態(比例尺:100 μm)。C)用GFP質粒DNA轉染的HEK 293 T細胞在具有Imm斑點尺寸的液滴微陣列上的代表性圖像(比例尺:Imm)。用GFP質粒DNA轉染的D)HEK 293 T細胞、E)CHO-K1細胞和F)Jurkat懸浮細胞的單個微滴的熒光顯微鏡圖像(比例尺:100 μm)。
藥物分配:通過I.DOT將774種FDA批準藥物(1、10、30 μM三個濃度)以20 nL/spot分配至500 μmDMA,真空干燥去除DMSO(避免細胞毒性)[1](圖 2A)。
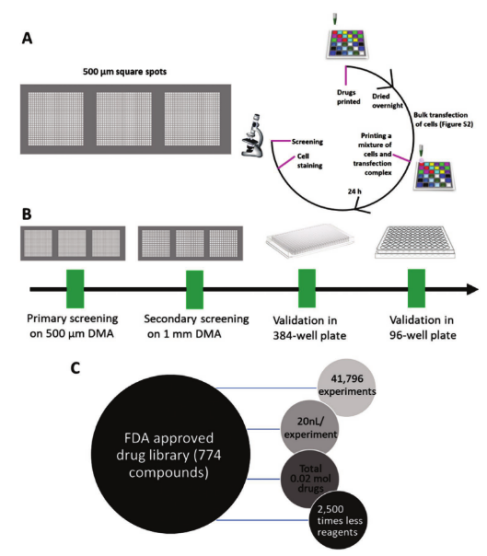
圖2. 原代細胞篩選的工作流程。A)將774種FDA批準的藥物作為DMSO溶液印刷在500 μmDMA載玻片上,并在真空干燥器中干燥過夜。然后將與轉染混合物(ScreenFectA轉染試劑,GFP質粒DNA)混合的細胞印刷到每個斑點中,并與藥物孵育24小時,然后固定和熒光顯微鏡分析。藥物的最終濃度分別為1、10和30×10?6m。將初篩的14種命中化合物打印到1mm DMA載玻片上,并以相同的方式重復該過程,除了使用更大的濃度范圍:1、5、10、20、30和40×10?6m。對于無藥物對照實驗,將轉染混合物打印到空點中。B)設計用于轉染增強劑篩選的高通量篩選方法。在500 μmDMA載玻片(每次實驗20 nL)上進行初步篩選,在1mm DMA載玻片(每次實驗100 nL)上進行二次篩選。在常規高通量篩選平臺384孔板中進行進一步驗證和比較。最后,在優化條件下在96孔板中確認命中。C)篩選了774種FDA批準的藥物,共進行了41796次單獨實驗。各個水性隔室的體積為20 nL,其總共產生僅0.84 mL的總細胞懸浮液,并且僅需要200皮摩爾的藥物(總共0.02摩爾),這比必須在384孔板中進行相同實驗的情況小2500倍。
細胞與轉染復合物分配:I.DOT將含GFP質粒和轉染試劑(ScreenFectA)的CHO-K1、Jurkat、HEK293T細胞懸液以20 nL/spot分配至藥物預處理的DMA,濕度控制在70%以防止蒸發(圖 1B-D)。
檢測與量化:24小時后固定細胞,通過熒光顯微鏡計數GFP陽性細胞(轉染效率)、Hoechst染色(總細胞)、PI染色(死細胞)(圖1C)。
CHO-K1 細胞(難轉染):以GFP陽性細胞數量為指標,初篩結果顯示藥物對轉染效率的影響具有濃度依賴性(圖3A)。在1 μM濃度下,425種藥物表現出轉染增強效應,349種抑制;10 μM時,624種增強(數量最多),150種抑制;30 μM時,236種增強,538種抑制。這可能與藥物對細胞內吞、轉染復合物運輸及定位的影響差異有關。通過“對照組均值+3倍標準差”閾值,初篩獲得19個(1 μM)、78個(10 μM)和18個(30 μM)候選化合物(圖4),其中7種(如金諾芬、卡托普利等)在不同濃度下均表現出穩定增強效果。
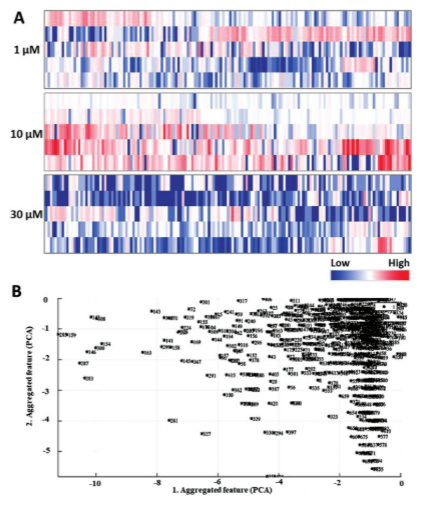
圖3. FDA批準的藥物對CHO-K1細胞轉染效率的影響。A)使用來自20898次總轉染實驗(三次生物重復和每次三次重復)的量化的相對轉染效率數據產生的熱圖。藍色和紅色分別表示與不添加藥物的對照相比,效率的降低或增加。使用了三種不同的藥物濃度:1、10和30×10?6m。B)使用主成分分析(PCA)評分圖的初步篩選結果的概述。每個數字代表FDA批準的藥物庫中的一種藥物。
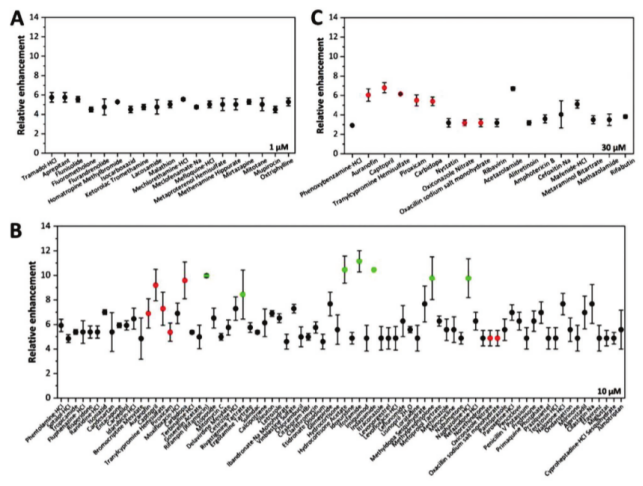
圖4. 在CHO-K1細胞的初步篩選中鑒定為轉染增強劑的命中化合物。A)774種FDA批準的藥物中的19種是從1×10-6 μM濃度的CHO-K1細胞的初步篩選中獲得的。B)在10×10?6m濃度下鑒定出78種命中化合物。C)在30×10-6 μmCHO-K1細胞處初步篩選獲得的18種命中化合物的散點圖。紅色表示化合物(金諾芬、卡托普利、半硫酸反苯環丙胺、吡羅昔康、卡比多巴、苯唑西林鈉鹽一水合物和硝酸奧昔康唑)在不同濃度下顯示可重復的正增強作用,綠色表示化合物(利福平、酒石酸卡巴拉汀、醋酸氫化可的松、異環磷酰胺、吲達帕胺、甲潑尼龍和鹽酸萘唑啉)在一個濃度下顯示強增強作用。數據表示為三次生物學實驗的平均值±SD,每次三次技術重復。
Jurkat 細胞(懸浮細胞,轉染難度高):初篩中陽性結果顯著少于CHO-K1細胞。1 μM時244種藥物增強,530種抑制;10 μM時325種增強,449種抑制;30 μM時192種增強,582種抑制。僅在10 μM和30 μM時各篩選出2個和1個候選化合物,且因細胞本身轉染效率極低,增強倍數僅為6-8倍(相對值)
可靠性驗證:通過主成分分析(PCA)對初篩結果進行驗證,顯示候選化合物與對照組差異顯著,與初篩算法結果一致(圖3B),排除了假陽性信號。
從初篩中選取14種增強效果顯著或穩定的化合物(如氫可的松acetate、異環磷酰胺等),在1mmDMA平臺上開展濃度梯度(1-40μM)驗證(圖2B),并引入HEK293T細胞(易轉染)作為對照;轉染效率方面,14種化合物均表現出劑量依賴性,轉染效率較對照組提升1.8-5.1倍(圖5)。其中,吡羅昔康和反苯環丙胺半硫酸鹽在高濃度(30-40μM)下仍保持增強效果,而其余12種因細胞毒性在高濃度時效率下降。
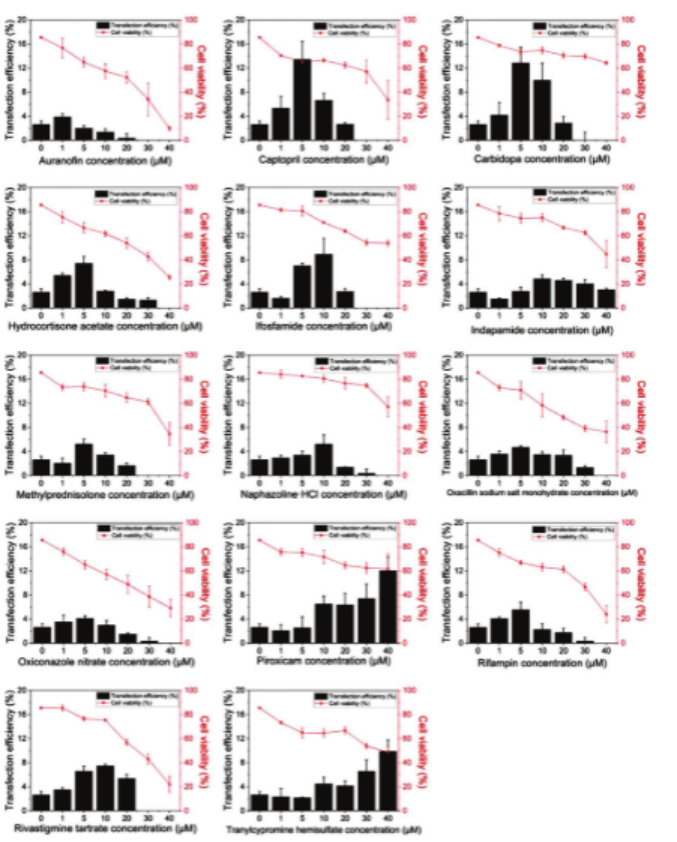
圖5.14種命中化合物對GFP質粒DNA轉染CHO-K1細胞的影響。將不同量的14種命中化合物(金諾芬、卡比多巴、卡托普利、醋酸氫化可的松、異環磷酰胺、吲達帕胺、苯唑西林鈉鹽一水合物、甲潑尼龍、鹽酸萘甲唑啉、利福平、硝酸奧昔康唑、吡羅昔康、反苯環丙胺半硫酸鹽和酒石酸卡巴拉汀)印刷到1mmDMA上,在真空中干燥。
細胞活力:14種化合物均隨濃度升高導致細胞活力下降(PI染色檢測),提示轉染增強效果需平衡藥物毒性。
HEK293T細胞驗證:與CHO-K1趨勢一致,轉染效率提升1.2-3.5倍,進一步支持候選化合物的通用性;而Jurkat細胞未觀察到顯著增強,可能與其本身轉染障礙相關。
384孔板驗證:CHO-K1細胞在最佳濃度下的轉染效率與1mm DMA結果趨勢一致(圖6),盡管384孔板中單個反應的細胞數量更多(1135個/孔vs100個/斑點),但平均效率無顯著差異,證明DMA結果可遷移至傳統平臺。
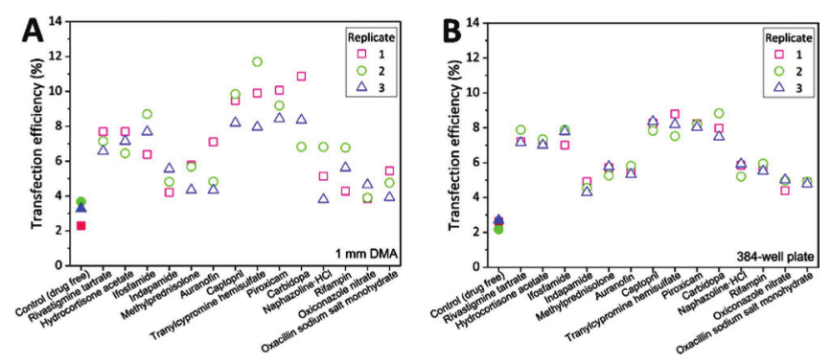
圖6. 在最佳濃度下,在A)1mm DMA和B)CHO-K1細胞的384孔板上的單個斑點中,兩種形式的所有三個分析重復中,來自初步篩選的命中化合物的影響。單獨顯示了每個拍攝的圖像/每個孔(每個斑點)中的轉染效率。不同的形狀表示單個重復(重復1-正方形,重復2-圓形和重復3-三角形)。根據二次篩選,每種藥物的最佳工作濃度用于每種藥物(表S2,支持性信息)。用在10μLScreenFect稀釋緩沖液中的0.017 μLScreenFectA制備轉染復合物,隨后將在稀釋緩沖液中的總共17ngGFP質粒DNA稀釋至10 μL的最終體積(ScreenFectA與質粒DNA的比例為1:1)。然后將濃度為7.13×104個細胞mL-1的80 μL新鮮細胞懸液加入復合物中,然后混合并以20 μL/孔的體積接種到每個孔中。數據表示為三次生物學實驗的平均值±SD,每次三次技術重復。
96孔板優化驗證:選取4種化合物(氫可的松acetate、萘甲唑啉?HCl等),在優化轉染參數(0.4 μL轉染試劑+100 ngDNA/孔)后,轉染效率從對照組的30.3%提升至33.9%-38.8%,進一步確認了其增強效果。
該研究證明DMA平臺在超微量高通量篩選中的巨大潛力:僅用0.84 mL細胞懸液和0.02μmol藥物完成4萬余次實驗,成本降低2500倍。14種陽性化合物(如金諾芬、卡比多巴等)可將轉染效率提升至5倍,為基因治療載體優化與蛋白生產提供新工具。
I.DOT非接觸分配技術在微量液滴精準操控中的應用,解決了傳統打印的蒸發與污染問題,推動DMA成為細胞生物學與藥物篩選的革新性平臺。未來該技術有望拓展至更多高通量場景,加速生物活性分子的發現進程。




