癌癥治療的核心挑戰之一,是如何利用有限的患者活檢樣本快速篩選有效藥物。傳統384孔板單次實驗需20,000個腫瘤細胞,而細針穿刺活檢通常僅能獲取約50萬細胞,且需優先滿足病理診斷,導致體外藥物敏感性測試(DSRT)常因樣本不足而受限。德國卡爾斯魯厄理工學院團隊開發的液滴微陣列(DMA)平臺,聯合I.DOT納米級分配技術,將單孔細胞用量降至100個、藥物消耗減少300倍,為稀缺樣本的高效利用開辟新路徑。
1、DMA 玻片采用親水-超疏水圖案化設計:
親水斑點:通過硅烷化處理和硫醇-炔點擊化學,在玻璃表面形成1mm2親水區域(水接觸角<10°),支持納升液滴穩定形成;
超疏水背景:全氟癸硫醇修飾的超疏水邊界(接觸角>150°),確保液滴獨立分離,單滴體積80-100 nL(圖1a)
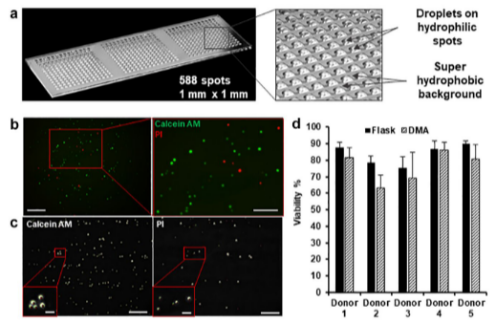
圖1. DMA平臺。(a)含有水滴的非聚合物DMA載玻片的照片。這張照片是由KIT跨媒體部門的團隊拍攝的。(b)在聚合物DMA上孵育48小時并用鈣黃綠素AM和PI染色的原代CLL細胞的顯微鏡圖像。比例尺= 100 μm,插入50 μm。(c)使用內部開發的算法顯示細胞計數的顯微鏡圖像。比例尺= 100 μm,插入20 μm。(d)圖顯示了從五個不同供體分離并在聚合物DMA載玻片(黑色條)和細胞培養瓶(虛線條)中培養48小時的CLL細胞的活力的比較。
1、細胞接種
使用I.DOT納米級分配器(DispendixGmbH),將原代慢性淋巴細胞白血病(CLL)細胞懸液(濃度100×10?cells/mL)以100nL/滴精準分配至親水斑點,單滴平均含100個細胞,細胞數變異系數(CV)<5%(圖1c)。
2、藥物打印
抗癌藥物(如阿霉素、AZD7762)溶解于DMSO后,經I.DOT以納升級體積打印至疏水玻片,通過三明治法與細胞液滴接觸,確保藥物轉移率>95%,最終濃度覆蓋0.041-200μM(圖2)。
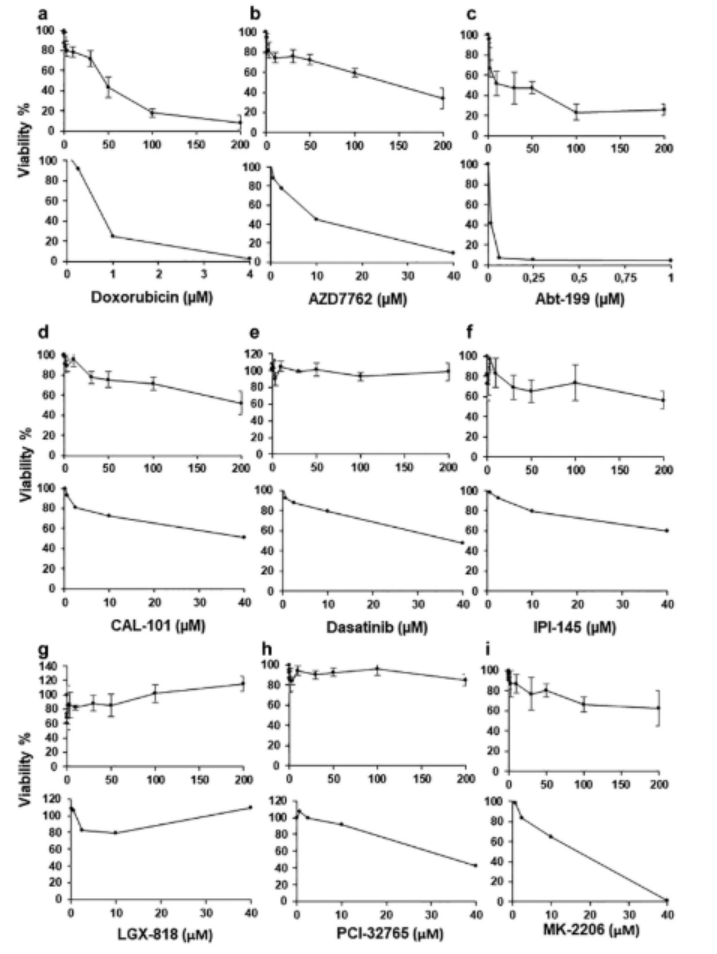
圖2. 在聚合物DMA平臺上比較化合物對從供體1分離的原代患者源性CLL細胞的劑量依賴性作用(上圖)和384孔板(下圖):(a)多柔比星,(B)AZD7762,(c)Abt-199,(d)CAL-101,(e)達沙替尼,(f)IPI-145,(g)LGX-818,(h)PCI-32765,和(i)MK-2206。在DMA平臺的情況下,平均值取自四次重復;誤差條是標準偏差。在384孔板的情況下,我們每個濃度僅重復一次。應注意,DMA和384孔板的x軸刻度不同
抗癌藥物(如阿霉素、AZD7762)溶解于 DMSO 后,通過 I.DOT 納米級分配器以納升級體積打印至疏水玻片,采用三明治法與細胞液滴接觸,確保藥物轉移率> 95%,最終濃度覆蓋 0.041–200 μM(圖 2)。
細胞接種后孵育2小時,通過I.DOT分配染色液(CalceinAM/PI)進行活死細胞染色,15分鐘內完成588個液滴的熒光成像(OlympusIX81顯微鏡),結合ImageJ算法自動計數細胞活力(圖1b)。
1、超高效樣本利用
與384孔板相比,DMA平臺聯合I.DOT技術將細胞用量從20,000 cells/孔降至100cells/滴(↓200倍),藥物消耗從10nmol/孔降至0.03 nmol/滴(↓300倍),試劑體積從25,000nL/孔降至50nL/滴(↓500倍)(表1)。
表1. 在DMA平臺和384孔板上進行篩選的化合物、細胞和試劑的工作流程和消耗比較。

2. 數據一致性與可靠性:
對9種抗癌藥物的劑量-反應曲線顯示,DMA平臺與384孔板的IC50值高度吻合(如阿霉素IC50:202.51μMvs.200μM),Z'因子(評估篩選性能的指標)達0.56-0.85(>0.5為“優秀”),證實微尺度培養未改變細胞對藥物的響應特性(圖2、圖3)。
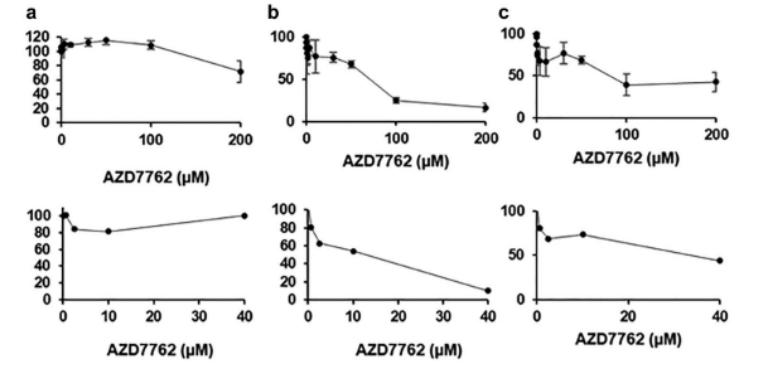
圖3. 化合物對在具有手動設置的聚合物DMA平臺(上圖)和384孔板(下圖)上從三個不同供體分離的原代患者來源的CLL細胞的劑量依賴性作用的比較:(a)供體3,(B)供體4,和(c)供體5。在DMA平臺的情況下,平均值取自四次重復;誤差條是標準偏差。在384孔板的情況下,我們每個濃度僅重復一次。應注意,DMA和384孔板的x軸刻度不同。
1、高通量能力
I.DOT支持單日處理100+樣本,單玻片集成588個液滴,較手動操作效率提升10倍,且非接觸式分配避免交叉污染(污染率<0.01%)。
2、成本優化
單藥物10濃度4重復實驗成本僅10歐元,不足384孔板(800歐元)的1/80,主要得益于納升級試劑消耗與自動化流程
對5例患者來源的CLL細胞測試顯示,DMA平臺可在48小時內完成藥敏分析,細胞活力維持在60%-85%,與培養瓶培養結果一致(圖1d),證明其對原代細胞的兼容性。
這項研究借助 I.DOT 技術的納米級精準分配能力,在 DMA 平臺上實現了對傳統藥物篩選技術的突破,通過將單孔細胞用量降至100個,解決了活檢樣本稀缺導致的原代細胞耗竭難題,使高效藥敏篩選在超微尺度下成為可能;其臨床價值體現在為兒童腫瘤、罕見癌癥等樣本獲取困難的病癥提供了可行的體外檢測方案,支持治療過程中動態耐藥監測與藥物重定位,推動個體化醫療的精準化實踐;未來研究可進一步結合3D培養(如水凝膠支架)與人工智能數據分析,構建更貼近體內生理環境的篩選模型,加速實驗室成果向臨床應用的轉化[1,2]。該研究不僅驗證了I.DOT與DMA平臺在微尺度篩選中的協同優勢,更通過技術創新開啟了精準醫療領域的新方向,有望成為未來癌癥個體化治療中高效篩選與精準用藥的核心工具。

同騰睿杰(上海)生物技有限公司作為CYTENA I.DOT中國總代理商,為您提供優質的售前售后服務。
聯系電話:021-50826962
聯系郵箱:sales@ttbiotech.com
1. Neto, A. I.; Demir, K.; Popova, A. A.; et al. Fabrication of Hydrogel Particles of Defined Shapes Using Superhydrophobic-Hydrophilic Micropatterns. Adv. Mater. 2016, 7613–7619.
2. Tronser, T.; Demir, K.; Reischl, M.; et al. Droplet Microarray: Miniaturized Platform for Rapid Formation and High-Throughput Screening of Embryoid Bodies. Lab Chip 2018,18, 2257–2269.




