由新型冠狀病毒(SARS-CoV-2)感染引起的急性呼吸系統綜合癥,對人類的生命健康產生了極大威脅。病毒顆粒的刺突蛋白(Spike)與人類的血管緊張素轉化酶2(hACE2)分子受體相互作用,是病毒感染入侵人體的主要機制。為了深入研究其相互作用及動力學機制,本文利用傳統酶聯免疫吸附檢測技術(ELISA)及新型熒光距離感應技術(SwitchSENSE),從以下四方面對分子間的相互作用動力學進行了詳盡的評估:
-
全長的病毒刺突蛋白,僅含有蛋白的RBD結構域以及僅含有S1亞基的片段與hACE2受體蛋白肽的結合差異;
-
兩種分子之間的單價互作與兩分子的三價形式互作之間的動力學差異;
-
刺突蛋白的氨基酸序列突變對互作動力學的影響;
-
hACE2受體肽和失活的冠狀病毒顆粒及假病毒顆粒之間的互作動力學;
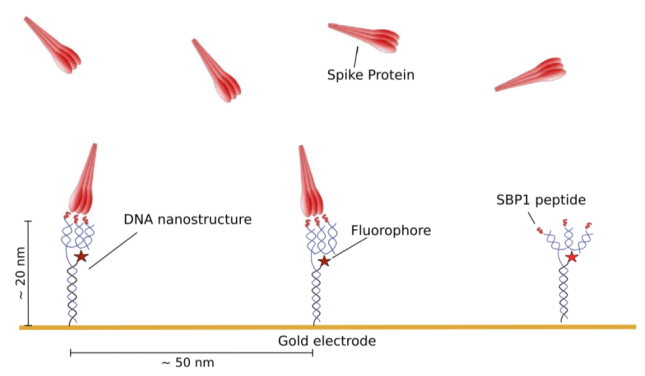
SwitchSENSE技術的實驗設計模式圖總覽
熒光距離接近感應SwitchSENSE技術是由德國Dynamic Biosensor生物技術公司開發的一種基于微流控芯片的分子互作技術。該技術以耦合在生物芯片上的DNA納米桿為載體,納米桿可同時攜帶熒光基團及分子互作配體。芯片在處于合適的電場中時,DNA納米桿可保持直立靜止的狀態;當含有底物的緩沖液在微流控作用下流經芯片表面時,配體與底物分子發生相互作用,該相互作用改變了熒光基團所處的化學環境,導致熒光信號發生變化。該變化的熒光信號通過儀器對發出的光子進行捕捉并計數,進而對分子間相互作用動力學及親和性進行實時的檢測。
相較于傳統的ELISA半定量技術,該技術可對光子數進行絕對測量;同時,由于DNA分子的柔韌性及堿基互補配對原理,使得在芯片表面固定多價分子(參見模式圖)成為可能。這也是本文應用SwitchSENSE技術進行該研究的優勢之一。
在病毒入侵和感染的過程中,關于病毒表面刺突蛋白與呼吸道組織細胞膜受體蛋白的相互作用研究十分重要。能夠與刺突蛋白進行互作的蛋白多肽,在相關研究或診斷治療中,都是十分有價值的工具。尤其是模擬刺突蛋白與細胞表面受體結合序列的多肽,能夠抑制病毒顆粒對宿主細胞的黏附和融合。本文用于進行相關研究的SBP1多肽,來自于hACE2蛋白氨基端的a螺旋序列,由23個氨基酸構成。已經報道,SBP1與SARS-CoV-2的受體結合域(RBD)存在uM級的親和性。本文在已有研究的基礎上,進一步測定了SBP1與刺突蛋白不同亞單位,以及與含有不同突變的刺突蛋白之間的互作效應。
本研究中使用了以DNA納米桿為結構基礎的SwitcSENSE技術,該技術的優勢在于,它可以在芯片表面偶聯三價配體(此處指SBP1),與三聚刺突蛋白的表位相對應。它非常靈活的改變芯片表面的配體偶聯,使得單價偶聯和多價偶聯成為可能,而不同價位與刺突蛋白不同表位的協同結合作用,也是實際應用中需要明確的關鍵信息。因此本文采用的策略是使用四條DNA序列,通過互相堿基互補配對雜交,形成能夠結合三個多肽序列的DNA納米骨架(參見模式圖)。本文同時運用該結構與單價偶合肽的互作進行了動力學的比較。
在互作結合的技術選擇上,本文同時選擇了傳統的ELISA檢測技術,同樣使用以DNA為基礎的肽-DNA偶聯形式,目的在于希望能夠證明這種以DNA-肽結構的單價結合形式可以在不同的技術背景中進行運用,比如表面等離子共振技術(SPR),流式細胞術等。
通過四條堿基互補配對的DNA鏈,將SBP1-DNA納米結構進行整合,并通過聚丙烯酰胺凝膠電泳(PAGE)對蛋白和核酸的偶聯情況及結構的折疊情況進行鑒定。首先,本文將四條攜帶有配體SBP1的DNA臂固定在芯片上,然后觀測SARS-CoV-2刺突蛋白與SBP1的結合動力學。
本實驗中分別檢測了SARS-CoV-2刺突蛋白的兩個亞基和全長蛋白與SBP1的結合。刺突蛋白包含S1和S2兩個亞基,其中S1亞基包含RBD區域,該區域經證實為與SBP1的互作區域。本實驗選擇S1亞基,RBD區域和全長蛋白分別進行檢測。結果如下圖所示:
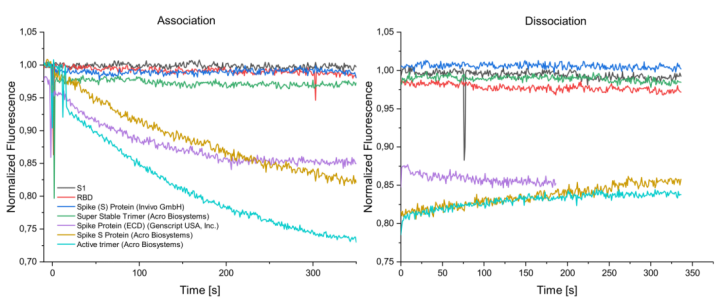
結果表明,S1亞基與RBD結構域均未能和SBP1進行結合,而來自不同公司的全長蛋白,SARS-CoV-2刺突蛋白(ECD),SARS-CoV-2 S蛋白和SARS-CoV-2S, active trimer與SBP1具有明顯的結合動力學表征。而兩個攜帶突變氨基酸的全長蛋白SARSCoV-2 S, Super Stable Trimer和Spike(S) protein未表現出結合能力。這兩種突變蛋白攜帶多個突變,包括位于Furin蛋白酶切位點區域的R683A,R685A突變以及K986P和K987P位點突變。已有報道Furin蛋白酶切位點對于刺突蛋白與配體的結合活性非常重要,而986和987氨基酸位點被證明可以阻止刺突蛋白從融合前狀態到融合后狀態構象的變化,因此對于生物體來說是非常有利的突變。
本實驗通過SwithSENSE和ELISA技術分別比較了全長刺突蛋白SARS-CoV-2 S protein,SARS-CoV-2 S protein, active trimer和攜帶三肽或僅攜帶一肽的DNA納米結構的結合。結果如下圖所示:
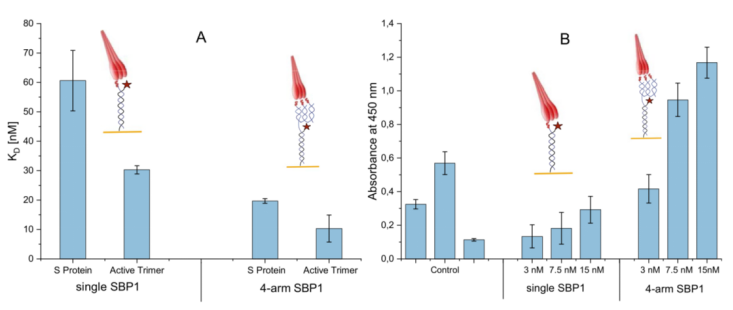
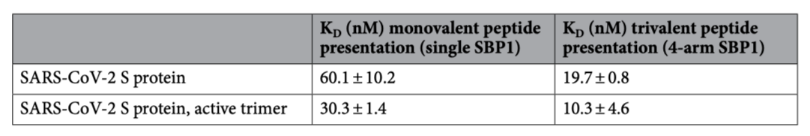
A和B分別為SwitchSENSE技術以及ELISA技術檢測結果。結果顯示,分子間的單價互作和三價互作在兩種技術中顯示出一致性,兩種全長蛋白在分子三價互作中,其動力學親和性均較單價互作強。具體檢測數值請見下表:
為了證明DNA-SBP1納米結構不僅可以與溶液中的刺突蛋白進行互作,也能夠與病毒顆粒表面的蛋白進行結合,本實驗使用了化學刺激失活后的病毒顆粒與攜帶三肽的DNA-SBP1納米結構進行動力學表征檢測。將DNA-SBP1納米結構進行固定,病毒顆粒溶液以不同的濃度進行微流控上樣。由于病毒顆粒平均直徑約為90nm,而兩個DNA納米結構之間的距離約為50nm。因此一個病毒顆粒理論上可以與一個以上的DNA納米結構進行結合。結果與示意圖如下所示:
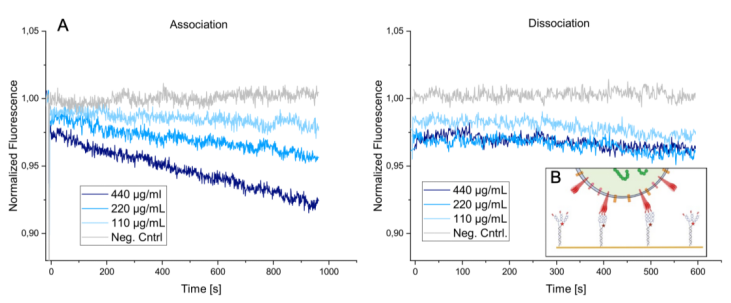
結果表明,在病毒顆粒結合期間,隨著病毒顆粒濃度的增加,可見熒光信號強度減弱加快,表明結合性能增強;但病毒顆粒與配體的結合,呈現出線性結合,而非指數形式的結合曲線;在600s的解離時間內,未觀測到解離的發生,表明病毒顆粒與配體具有較強的結合性能。
本實驗采用慢病毒包裝系統,產生表達刺突蛋白的病毒顆粒。產生的病毒顆粒同樣使用化學誘導失活,并進行純化和濃縮后用于動力學檢測。結果如下圖所示:
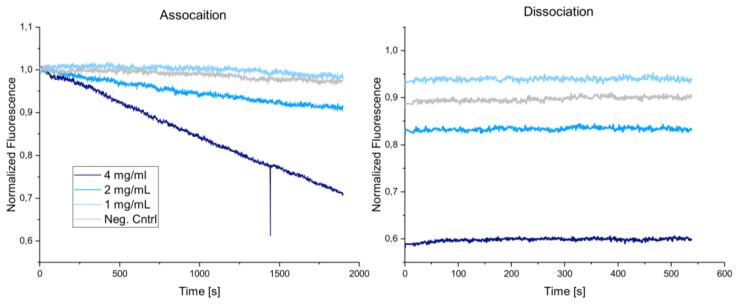
結果表明,隨著假病毒顆粒濃度的增加,顯示出與配體較強的結合性能,并且與上述病毒顆粒相同,結合曲線表現為線性變化, 600s的解離時間內,未觀測到解離的發生。在該實驗中,病毒所需要的濃度要高于上述病毒顆粒,推測其原因是由于假病毒與天然病毒在樣本制備和樣本特性方面的各種差異所導致,比如刺突蛋白在兩種病毒顆粒上表達的密度等差異。
假病毒顆粒中的刺突蛋白可以經由基因工程的方法進行突變,構建攜帶突變位點的假病毒顆粒。根據目前存在的SARS-CoV-2突變株,進行假病毒的包裝。本實驗中測試了三種不同的刺突蛋白突變體,命名為野生型(最初在中國武漢發現),B1.1.7或稱Alpha突變體(最初在英國發現)和B1.351或稱Beta突變體(最初在南非發現)。與野生型相比,兩種突變體均展現出了差異較大的結合性能。結果如下圖所示:
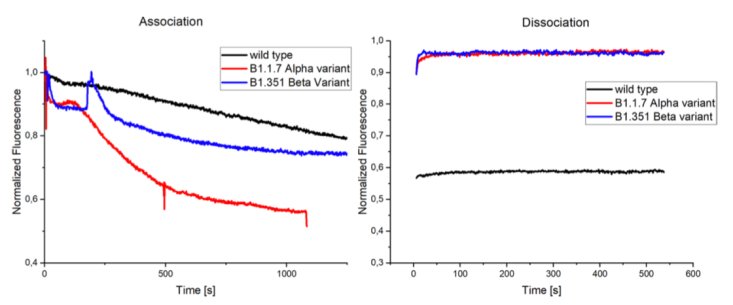
實驗結果表明,三種病毒顆粒均展現出較強的結合性能,其中B1.1.7毒株展現出了最快最強的結合性能,其測試濃度也是最低的。與典型的野生型的線性結合相比,兩種突變毒株與配體肽的結合均出現指數的變化;在600s內未觀測到解離的發生,表明其具有較強的結合能力。

heliX+ 分子互作分析系統

heliXcyto原生分子互作細胞分析系統
同騰睿杰(上海)生物科技有限公司作為Dynamic Biosensors中國總代理商,為您提供優質的售前售后服務。
聯系電話:021-50826962
聯系郵箱:sales@ttbiotech.com




