除了蛋白質的經典功能(例如充當生物催化劑或結合partner)之外,還需要考慮蛋白質的構象狀態及其在刺激下的重塑。經歷全面構象重塑的蛋白質的一個突出例子是轉谷氨酰胺酶 2 (TGase 2),其不同的構象狀態與特定功能密切相關。它參與各種病理生理過程,包括纖維化和癌癥,這推動了治療診斷劑的開發,特別是基于針對轉酰胺酶活性的抑制劑。在這種情況下,此類抑制劑控制 TGase 2 構象動力學的能力成為一個重要參數,所以亟需評估這種特性的方法。本文描述了 switchSENSE® 原理的應用,用于檢測由三種不可逆結合的 Nε -丙烯酰賴氨酸哌嗪引起的構象變化,這三種不可逆結合的 N" -丙烯酰賴氨酸哌嗪是 TGase 2 的合適放射性示蹤劑候選物。switchSENSE® 技術基于由交變電場驅動的 DNA 納米桿。這些杠桿的一端固定在金電極上,而杠桿的另一端則與 TGase 2 共價結合。通過一種新的計算方法來描述由此產生的杠桿運動,以量化刺激的構象 TGase 2 變化的程度。此外,作為一種補充的生物物理方法,在類似條件下進行了天然聚丙烯酰胺凝膠電泳以驗證結果。這兩種方法都證明了 三種研究的 Nε -丙烯酰賴氨酸哌嗪的結合引起了TGase 2 的構象平衡發生了不可逆轉變。
蛋白質是構象動態分子,即使在其天然狀態下也會經歷一系列構象 [1,2]。因此,人們利用構象自由能圖景制定了一個熱力學概念,描述構象亞態和蛋白質的波動 [2–4]。從生化過程來看,蛋白質構象集合的重塑是細胞信號傳導的核心方面 [5]。它也可以被視為一種離散信號傳導[6]。構象靈活性是蛋白質的固有特性。然而,運動的種類和程度可能有所不同,從鍵振動和側鏈旋轉到域的集體運動 [3,7]。關于后一種蛋白質運動,已知經歷顯著構象重塑的蛋白質是轉谷氨酰胺酶 2 (TGase 2)。TGase 2 是一種酶,它通過將蛋白質結合的谷氨酰胺殘基的酰基轉移到一級胺(轉酰胺酶活性),包括蛋白質結合的賴氨酸殘基和低分子量的生物胺和多胺,來催化 Ca2+ 依賴性的蛋白質翻譯后修飾 [8,9]。除了這種酶功能外,TGase 2 還具有其他酶和非酶功能。例如,TGase 2 結合和水解 GTP 并充當二聚 Gh 蛋白的 Gαh 亞基 [10–12]。在此背景下,Ca2+和GDP/GTP分別作為GTP結合功能和轉酰胺酶活性的變構調節劑。此外,這些分子的結合伴隨著TGase 2的構象重塑[10,13]。
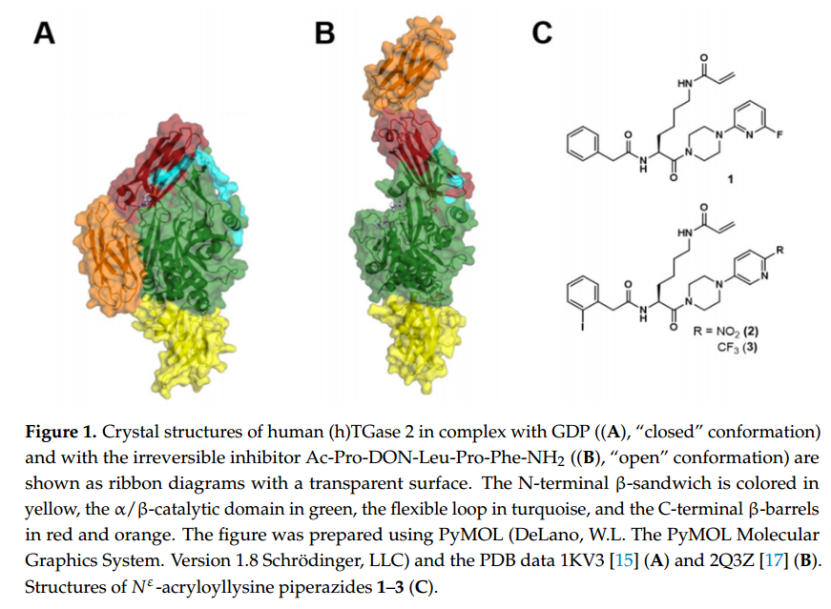
TGase 2 是一種單體蛋白,由 687 個氨基酸組成,摩爾質量為 77 kDa [14]。TGase 2 的結構由四個不同的結構域組成。N 端 β 夾層(氨基酸殘基 1-139)后面是 α/β 催化核心(氨基酸殘基 140-454),其中包含轉酰胺酶活性的催化三聯體(Cys-277、His-335 和 Asp-358)。該結構由兩個連續的 β 桶(氨基酸殘基 479-585 和 586-687)完成。核苷酸結合(GDP、GTP、ATP)TGase 2 的 X 射線晶體結構揭示了 TGase 2 的緊湊(“封閉”)構象,其中 C 端 β 桶狀結構折疊在 α/β 催化域前方(圖 1A)[15,16]。與核苷酸結合的 TGase 2 相反,與不可逆結合肽抑制劑復合的 TGase 2 的 X 射線晶體結構揭示了細長的(“開放”)構象,其中 C 端 β 桶狀結構不會遮擋進入轉酰胺酶活性位點的通道(圖 1B)[17]。α/β 催化核心與后續 β 桶狀結構之間的柔性環(氨基酸殘基 455–478)被認為是鉸鏈區,允許 β 桶狀結構移動 [15,17–19]。盡管抑制劑結合的 TGase 2 的結晶是在 Ca2+ 存在下進行的,因為 Ca2+ 是結合轉酰胺酶定向化合物所必需的,但在抑制劑結合結構中未發現 Ca2+。因此,人們通常假設但推測“開放”構象是否是 Ca2+ 激活構象(或它們的集合)的代表性快照。在這種情況下,在解析 TGase 2 的第一個晶體結構之前,Carlo Bergamini 團隊根據因子 XIIIa(TGase 家族的另一個成員)的同源模型進行了小角度輻射散射(SAXS 和 SANS)和蒙特卡羅實驗。他們的結果表明,Ca2+ 的結合導致 C 端 β 桶的最小旋轉,從而揭示了活性位點 [18,19]。同樣,Di Venere 等人 根據光譜技術(CD、穩態和動態熒光)的結果,認為 Ca2+ 會誘導 TGase 2 結構的“開放”[20]。除了結晶、輻射散射、光譜和模擬方法外,還通過其他各種方法評估了 TGase 2 的構象變化[21]。這些方法包括電泳法,例如天然(非變性)凝膠電泳[17,22–27]、動力學毛細管電泳[28,29]和通過質譜監測的氫/氘交換(HDX-MS)[30]。雖然這些方法主要側重于研究分離的 TGase 2 和各種配體的構象效應,但基于 F?rster 共振能量轉移的分析被用于研究活細胞中 TGase 2 的構象動力學[31,32]。所有提及的研究都證明,TGase 2 在核苷酸結合形式和 Ca2+ 激活或抑制劑結合形式之間發生了顯著的構象重塑。
由于細胞內 GTP(≈100–150 μM)和 Ca2+(≈0.1 μM)濃度,TGase 2 在細胞內采用與“閉合”構象相關的構象,因此在生理條件下被認為基本上不具有轉酰胺酶活性 [31–33]。在與 Ca2+ 穩態喪失相關的生理應激情況下,會發生向“開放”構象的構象重塑;事實上,Ca2+ 水平會升高,蛋白質會變得具有轉酰胺酶活性 [31,32]。而轉酰胺酶TGase 2 主要在細胞外環境中發揮 TGase 活性,并被認為與纖維化 [34–37]和乳糜瀉 [38,39] 等病理生理過程有關。各種腫瘤實體的特征是 TGase 2 表達增加,這與不良預后有關 [40]。此外,TGase 2 似乎對癌癥干細胞的存活至關重要 [41–44]。這使得 TGase 2 成為治療診斷方法中一個有吸引力的腫瘤相關靶點,主要關注轉酰胺酶活性導向的共價抑制劑,其誘導 TGase 2 構象重塑為“開放”構象。通過這些藥物的作用,轉酰胺酶活性受到抑制,GTP 的結合受到阻斷 [45–47]。此外,有人認為這種構象重塑本身具有細胞毒性 [48,49]。因此,評估新化合物對 TGase 2 構象動力學的影響非常重要。
一種用于此類評估的新興技術是 switchSENSE®,如圖 2 所示。這種動態方法基于金電極上的電驅動 DNA 杠桿與高度時間分辨的熒光檢測相結合。除了多聚陰離子性質外,杠桿理想情況下還應具有盡可能大的機械剛度。因此,在大多數情況下,雙鏈 (ds) DNA [50–52],在某些情況下,特別是當需要驅動較重的蛋白質時,甚至更硬的 DNA 折紙結構也被用作杠桿 [53,54]。為了在表面上制備此類致動器,金電極用硫醇修飾的單鏈 (ss) DNA 寡核苷酸進行功能化。這些 ssDNA 鏈中的每一條都在其硫醇部分的對面末端帶有熒光團。在本研究中,第一步,通過表面結合寡核苷酸與互補 ssDNA 鏈雜交形成 48 個堿基對長的 dsDNA 桿(圖 2A)。然后,通過電觸發時間相關單光子計數 (E-TCSPC) 記錄所得的 16.3 nm 長的裸 dsDNA 桿的運動。當分別通過向電極施加正或負電位使桿被電極吸引或排斥時,這種動態模式能夠以 100 ns 的時間分辨率檢測熒光強度。熒光強度與熒光團與金表面的距離相關。由于能量轉移,隨著熒光團與金表面之間距離的減小,熒光不斷猝滅。 [55]
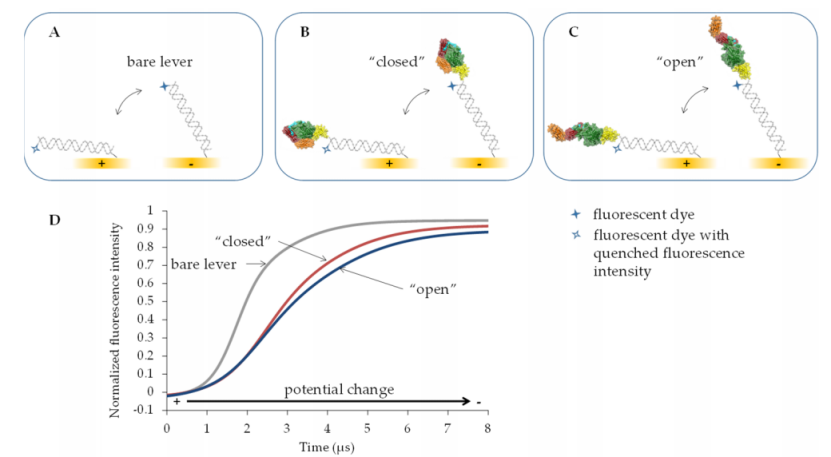

在獲取裸 dsDNA 杠桿運動動力學的參考值后,隨后進行脫雜化,為 TGase 2-ssDNA 結合物提供帶有 ssDNA 的電極表面。然后通過將電位從正值切換到負值來研究其遠端共價結合有 TGase 2 的所得雙鏈杠桿(圖 2B、C)。與裸 dsDNA 杠桿的運動相比,TGase 2-dsDNA 結合物的運動速度減慢,因為結合物的流體動力學流動阻力較大。后者改變的程度取決于附著的 TGase 2 的實際構象。為了量化由不同效應物引起的 TGase 2 構象變化的程度,本文使用了熒光強度增加(TGase 2-dsDNA 結合物向上運動)的動力學中的最大斜率(圖 2D)。“閉合” TGase 2 構象表現出大約 10 nm 的整體延伸,而“開放”構象則約為 15 nm(圖 1A、B)。因此,“閉合”構象預計會有更快的動態。在 switchSENSE® 技術的所謂靜態模式下,恒定電場使 DNA 杠桿相對于金電極保持直立 [56]。在這些條件下,可以通過熒光近距離傳感檢測分析物的結合。也就是說,分子相互作用以及靠近熒光團的構象變化可能會改變其局部環境,因此,熒光信號可以增強或減弱。在本研究中,我們表征了一種最近描述的(1,圖 1C)和兩種新的 N" -丙烯酰賴氨酸衍生的 TGase 2 不可逆抑制劑(2 和 3,圖 1C),以及它們對構象動力學的影響,使用 switchSENSE®。Staffler 等人 [57] 最近證明了該方法對 TGase 2 的適用性,主要側重于評估 GTP 類似物的結合動力學。在此,研究了兩種不同的 TGase 2 與寡核苷酸結合策略(非定向和 His 標簽定向胺結合)。此外,評估了 DMSO(1-3 儲備溶液的溶劑)和 Ca2+(轉酰胺酶活性 TGase 2 所必需的)對裸 dsDNA 杠桿運動的影響,以發現溶劑組成,避免了與杠桿相互作用而產生的偽影。關于動態模式下的數據分析,引入了一種新穎的計算方法,該方法包括將雙邏輯函數擬合到時間分辨的歸一化熒光強度。
對于 hTGase 2(以 His6 標記蛋白的形式購買)與 ssDNA 的結合,使用市售偶聯試劑盒應用了兩種不同的共價結合策略。第一種策略使用用 NHS 酯修飾的 ssDNA 通過其 N 端或賴氨酸側鏈標記 hTGase 2(以下稱為“非定向標記”)。對于第二種策略,采用 DNA 模板化蛋白質結合方法,使用 trisNTA 功能化的引導 DNA 將 NHS 功能化的 ssDNA 引導至 hTGase 2 的 N 端附近(以下稱為“His 標簽定向標記”)[62]。第二種策略旨在實現位點選擇性蛋白質結合,而非通過非定向標記隨機結合到任何可用的氨基上。通過這兩種策略,hTGase 2 成功與 ssDNA 偶聯,并純化了蛋白質-DNA 復合物(。然而,非定向標記提供的 ssDNA-hTGase 2 結合物的產量高于 His-tag 定向標記(基于所用的 hTGase 2 量,純化結合物的產量分別為 27% 和 11%)。值得注意的是,這兩種標記類型都使 ssDNA-hTGase 2 結合物與 ssDNA 功能化芯片的雜交效率相似。雜交后,在兩種情況下,在動態模式下操作期間,hTGase 2 結合的 dsDNA 桿與裸 dsDNA 桿的時間依賴性熒光信號有明顯差異(圖 2),即觀察到附著蛋白質的 DNA 桿向上運動較慢。
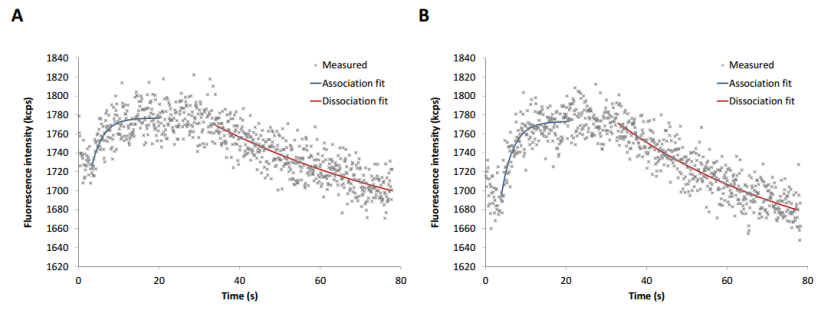
為了評估兩種標記類型的 GTPγS 結合動力學和 hTGase 2 伴隨的構象變化,首先應用靜態模式。為此,將 20 nM GTPγS 沖洗到電極上。在 GTPγS 存在下,熒光信號增加(結合,圖 3);通過去除核苷酸,熒光信號降低(解離,圖 3)。兩個 hTGase 2-dsDNA 杠桿的曲線模式相似。然而,與非定向標記(圖 3A)相比,His 標簽定向標記(圖 3B)提供了略高的熒光增加,同時伴有更高的信噪比。根據方程 (5) 和 (8) 進行回歸分析(參見材料和方法)給出了結合和解離的速率常數。解離常數 Kd 總結在表 1 中。兩種標記類型都產生了可比的動力學參數,Kd 值與 Staffler 等人在類似條件下獲得的值一致 [57]。

此外,GTPγS 和 Ca2+ 與 hTGase 2 的結合應在動態模式下影響 hTGase 2-dsDNA 杠桿的向上運動。與 DNA 杠桿結合的蛋白質的尺寸估計通常基于計算相應的流體動力學直徑,同時考慮蛋白質-DNA 結合物的切換運動和裸露的 DNA 杠桿的切換運動 [56]。然而,一方面,已知 TGase 2 結構是非球形的,另一方面,一組構象可能對測量的時間分辨熒光強度有貢獻。因此,所謂的“棒棒糖模型”可能不是最有利于構象變化分析的。特別是對于 TGase 2,Staffler 等人 [57] 報告了他們從 switchSENSE® 得出的流體動力學直徑與從晶體結構和動態光散射測量計算出的值之間存在明顯差異。因此,開發了一種新的計算方法,包括將雙邏輯函數擬合到時間分辨的歸一化熒光強度。在此基礎上,計算了擬合函數拐點處的最大斜率。該斜率的倒數應該與結合蛋白或蛋白-抑制劑復合物的結構變化引起的摩擦幾乎成比例。這意味著 DNA 桿向上運動的速度越慢,倒數斜率就越高,摩擦力也就越大。在這種情況下,我們假設結合酶的流體動力學摩擦取決于其構象(圖 2)。預計“開放”構象(圖 1B)將比“封閉”構象(圖 1A)產生更高的摩擦力。因此,時間依賴性的歸一化熒光強度應顯示更大的最大斜率,因此“封閉”構象的倒數斜率應小于“開放”構象(圖 2D)。此外,事實證明,將一系列要比較的條件中的所有倒數斜率除以在相關連續之前直接測量的裸 DNA 桿的倒數斜率是有利的。然后使用以這種方式獲得的相對倒斜率來量化酶的構象變化。Knezevic 等人 [50] 描述了一種類似的方法,即計算由快速傅里葉變換濾波器平滑的時間依賴性熒光曲線的一階導數的最大值。盡管如此,擬合雙邏輯函數來確定拐點還是有一些優勢的。此處使用的雙邏輯函數是適用于“S”形曲線的 S 形函數。該函數由兩個邏輯函數的總和形成 [63]。借助雙邏輯函數,可以充分描述歸一化熒光強度的完整、通常不對稱的時間分辨曲線。特別是,可以可靠地近似拐點周圍的區域。從得到的顯式最佳擬合函數中,可以獲得任意階的導數函數(相對于時間導出),以確定具有最大斜率的拐點。
事實上,在存在 GTPγS 的情況下,相對逆斜率明顯小于純緩沖液中不含 GTPγS 的情況(圖 4),因為已知 GTP 類似物會使 TGase 2 的構象動力學向“閉合”構象轉變(圖 1A)。隨后去除 GTPγS 并暴露于 Ca2+ 會增加相對逆斜率,甚至超過在沒有任何效應物的情況下 hTGase 2-dsDNA 杠桿的值(圖 4;有關動力學,請參閱補充材料中的圖 S2)。這反過來又與最近的數據一致,表明 Ca2+ 的結合有利于 TGase 2 形成相當細長的構象 [18–20,29,32],這應該會增加 DNA 杠桿的摩擦力(圖 2B)。在這種情況下,TGase 2 的構象重塑可能是各種中間構象的動態平衡,這有助于 hTGase 2-dsDNA 杠桿的摩擦力。因此,在沒有任何效應器的情況下,觀察到的摩擦力大概是中等強度的。
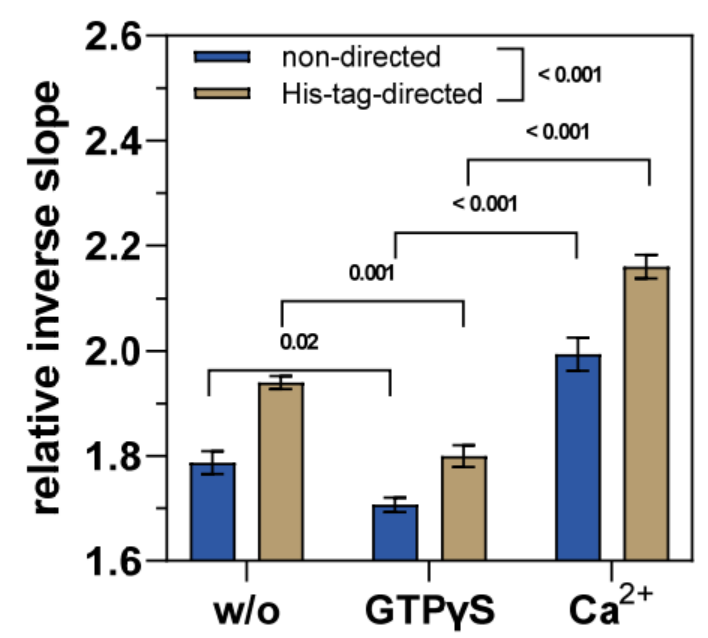

通過比較不同標記類型的結果,可以明顯看出 His 標簽引導標記產生的相對倒數斜率值明顯更高(p < 0.001)(圖 4)。這與在靜態模式下評估的 GTPγS 結合動力學的結果一致(圖 3)。因此,TGase 2 與 ssDNA 的位點選擇性偶聯(此處通過 His 標簽引導 DNA)對 switchSENSE® 兩種測量模式的數據質量都有積極影響,Staffler 等人最近也提出了這一建議 [57]。特別是對于 TGase 2,靠近 N 端的功能化是有利的,因為在用 GTP 類似物和 Ca2+ 刺激時,N 端 β 夾層較少參與構象重塑。但是,如上所述,His 標簽引導標記的主要缺點是制備結合物期間產量低。因此,我們決定利用非定向標記獲得的 hTGase 2-ssDNA 進行抑制劑 1-3 的構象影響實驗。
在分析抑制劑 1–3 對 TGase 2 構象動力學的影響之前,必須評估它們的抑制效力。雖然之前已顯示化合物 1 具有出色的抑制效力 [64],但化合物 2 和 3 代表新化合物。使用熒光測定法測定 2 和 3 的動力學抑制效力 [65],結果顯示 kinact/KI 值分別為 8340 M?1 s ?1 和 4500 M?1 s ?1 (表 2)。此外,在蛋白質和抑制劑預孵育 5 分鐘后,用熒光各向異性 (FA) 分析法測定了抑制轉酰胺酶活性的 IC50 值(2 和 3 分別為 154 和 280 nM,表 2)[64,66]。對于 SDS-PAGE 和天然 (GTP-)PAGE 實驗,我們使用了自制的 Twin-Strep 標記的 hTGase 2,該酶被化合物 1-3 抑制,其 IC50 值在市售的 His 標記的 hTGase 2 的范圍內(表 2,補充材料中的圖 S3)
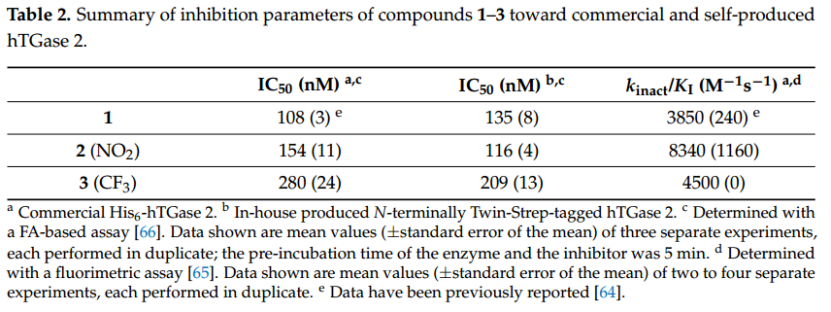
由于溶解度有限,抑制劑 1–3 的儲備溶液通常在 DMSO 中制備,因此用于生化和生物測定的最終 DMSO 濃度在 0.1% 至 5% 之間。為了確定 DMSO 的潛在干擾,我們使用不同的溶劑成分評估了裸露 DNA 桿的向上運動(圖 5)。雖然施加濃度為 1 mM 的 Ca2+ 不會改變時間依賴性熒光曲線的形狀,但與純水條件相比,1% DMSO 會導致曲線左移(圖 5A)。幸運的是,當 DMSO 濃度降低到 0.1% 時,曲線的形狀與水條件下的形狀基本相同(圖 5B)。因此,對于所有使用抑制劑 1–3 的 switchSENSE® 實驗,最終 DMSO 濃度均設置為 0.1%。目前無法給出觀察到 DMSO 影響的原因,但結果強調了仔細評估溶劑成分以避免測量偽影的必要性。

在驗證了它們的抑制活性并找到了合適的溶劑組成后,評估了化合物 1-3 對 hTGase 2 的構象影響。為此,應用了以下處理順序。(圖 6 中使用的所得溶劑組成和/或 hTGase 2-dsDNA 桿的狀態的符號用引號給出。)
1. 純 TE40 緩沖液(“w/o”);
2. 含 1 mM Ca2+ 的 TE40(“Ca2+”);
3. 純 TE40 緩沖液(去除 Ca2+;“Ca2+ 之后”);
4. 含 1 mM Ca2+ 和 10 μM 抑制劑的 TE40(“Ca2++ 抑制劑”);
5. 純 TE40(去除 Ca2+ 和抑制劑;“Ca2++ 抑制劑之后”)。
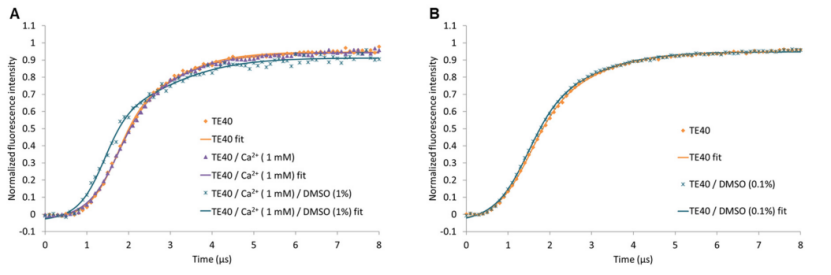
圖 6 顯示了相對倒數斜率對 hTGase 2-dsDNA 杠桿向上運動的影響。如前所述(圖 4),添加 Ca2+ 會增加摩擦力,因此,hTGase 2-dsDNA 杠桿的時間依賴性歸一化熒光強度曲線中的相對倒數斜率也會增加,在去除 Ca2+ 后,該曲線幾乎與添加 Ca2+ 之前相同(差異不具有統計學意義,圖 6 和 S4)。同時添加 Ca2+ 和抑制劑似乎會使摩擦力增加到比單獨添加 Ca2+ 更高的值(但這種差異對于所有抑制劑而言都不具有統計學意義,補充材料中的圖 6 和 S4)。對于抑制劑 3,隨后去除 Ca2+(“Ca2+ + 抑制劑之后”)會使摩擦力降低到與單獨添加 Ca2+(“Ca2+”)相似的水平,但與“w/o”和“Ca2+ 之后”相比仍顯著更高(圖 6)。對于抑制劑 1 和 2,這種趨勢相似;然而,應該注意的是,“Ca2++ 抑制劑后”與“w/o”和“Ca2+ 后”的差異中只有部分具有統計學意義(補充材料中的圖 S4)。因此,數據可能表明這三種抑制劑在不可逆結合后將 hTGase 2 的構象平衡轉變為更伸展的構象。Staffler 等人 [52] 最近使用 switchSENSE® 對肽類不可逆抑制劑 Z-DON-Val-Pro-Leu-OMe(“Z-DON”)獲得了類似的結果。面對不同條件之間相對逆斜率的輕微變化以及隨著治療周期的增加電極的某些老化效應,有必要使用互補方法來可視化由于配體的共價或非共價結合而導致的 hTGase 2 的構象變化。


heliX+分子互作分析系統采用switchSENSE®技術,通過共價偶聯或標簽捕獲方式將感興趣的分 子(配體)固定在heliX®芯片上,結合標準的自動化 工作流程為分子互作提供高效解決方案。
同騰睿杰(上海)生物科技有限公司作為Dynamic Biosensors中國總代理商,為您提供優質的售前售后服務。
聯系電話:021-50826962
聯系郵箱:sales@ttbiotech.com




