雙特異性抗體Emicizumab是血友病治療的創新性研究成果
血友病是一類X-連鎖遺傳性疾病,由于體內缺乏凝血因子VIII或IX導致,因此其疾病類型在臨床診斷中,目前分為兩大類:一類是由于VIII缺乏所致,占血友病比例約為80%,稱為A型;一類是由于IX缺乏所致,稱為B型。最初主要治療方法是選用重組凝血因子替代療法或輸注含有凝血因子的新鮮冰凍血漿等,主要的并發癥是產生抗VIII或IX的抑制性IgG抗體,限制了替代療法在疾病治療中的適用性。
Emicizumab是一種人源化的IgG4型雙特異性單克隆抗體,可以結合凝血因子IXa和X,橋連激活IXa和X,恢復凝血因子VIII的功能,發揮促凝血作用。雙特異性抗體可以與細胞膜表面的兩個不同的靶點結合,增強了抗體的靶向性和特異性,同時可以在生理性膜上誘導兩個不同的抗原在空間上相互靠近,從而發揮下游信號通路中的激活或抑制作用;更為關鍵的是,Emicizumab與FVIII不存在序列同源性,因此不會誘導或增強FVIII抑制物的產生。對廣大A型血友病患者來說,無疑是一種兼具創新性和可靠性的預防和治療措施。
雙特異性抗體抗與抗原結合的動力學研究具有來自傳統技術上的挑戰性
雙特異性抗體概念的提出已經具有五十年之久,近二十年,對雙特異性抗體的認識和研究才進入較快的發展階段。相比較單靶向抗體,雙克隆抗體具有多種多樣的作用機制,更多的結構序列上的突變和雙抗原結合分子動力學模式。其中,抗體與抗原的結合動力學研究,對于雙特性抗體的功能研究是至關重要的一部分。分子間相互作用形成的能力,相互作用的穩定性以及親和性,都將會影響分子之間互作后功能的發揮。對于兩分子之間的二元結合,上述參數的測量相對比較簡單,我們通常使用結合常數(Kon),解離常數(Koff)以及結合和解離的平衡常數((Kd))對分子之間的結合動力學行為進行表征。
對于二元復合物的生物學檢測方法多種多樣,主要包括表面等離子共振技術(SPR),生物膜干涉技術(BLI)等;SPR在進行二元復合物分子結合動力學研究中,首先需要將抗原分子固定在生物傳感器表面,將含有抗體分子的流動相流經生物傳感器,通過兩分子結合前后光的共振角度的變化,對結合和解離進行實時的測量;BLI利用光纖生物傳感器實時檢測分子之間的相互結合動力學,通過分子結合前后生物膜厚度變化導致的干涉波波長的移位,進行參數的定性;但是雙特異性抗體與靶抗原的結合,將主要以三元復合物的形式存在,其動力學行為,尤其是解離過程的動力學行為較二元復合物,變得更為復雜。以上傳統的技術都以單參數進行表征,無法對復雜的三元結合進行精確的動力學測量。
三元復合物中包含兩個二元復合物,且這兩個二元復合物之間存在相互作用和相互影響,改變了其單獨做為二元復合物時的動力學行為;同時,三元復合物中的三個分子,其結構,化學性質等都存在較大的差異,因此環境狀態的改變,比如分子濃度,分子的空間排列等,都會對分子之間結合的穩定性產生更為突出的影響;對于分子之間的解離,二元復合物的單向解離,比如抗體的單臂解離,代表了整體相互作用的分離,但對于三元復合物來說,單臂解離后,會因為兩臂的不同親和能力產生的滯留效應,會再次發生結合作用。Figure 1代表了不同的結合模式示意圖:
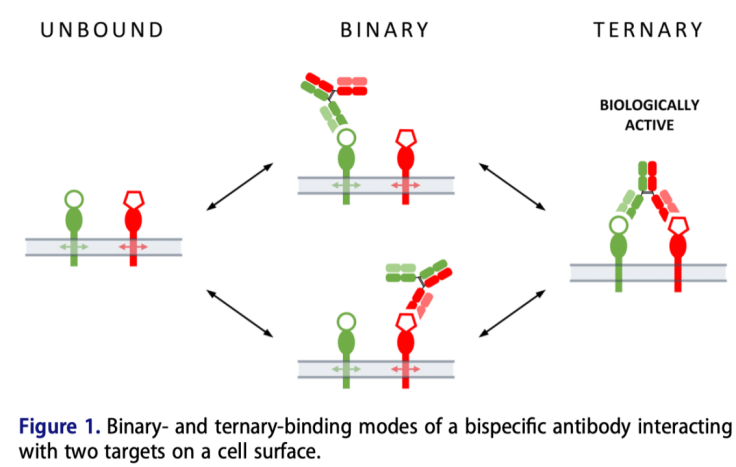
Figure 1代表了不同的結合模式示意
無論是SPR,還是BLI,在進行三元復合物測量時,其無法測量底物分子與表面分子結合的性質,化學計量比,不能夠區分復雜的解離狀態和判斷解離信號的來源,因此也無法測量三元復合物形成后的分子動力學親和性(Avidity)。但對于雙特異性抗體的早期研究來說,(1)抗體是否具有結合雙靶向分子的能力;(2)該雙靶向分子是否存在于同一細胞表面,在空間距離上是否能夠進行控制;(3)在化學計量比上是否可以模擬細胞膜表面狀態,對于其后期的優化和開發無疑是至關重要的。
新一代SwitchSence是解決三元復合物實時動力學研究的突破性技術
SwitchSence是基于流體動力學和生物傳感器芯片發展起來的一門應用性技術。其主要結構包括(1)含有DNA納米桿的芯片;(2)紅色與綠色兩種不同的熒光分子;(3)流體動力系統;其原理是將帶有熒光素的DNA分子和帶有配體的DNA分子進行堿基互補配對,進而實現DNA分子的雜交;雜交后的雙鏈DNA分子中的部分單鏈片段與芯片上存在的DNA錨定鏈進行再次雜交,形成具有攜帶配體與熒光素的功能化芯片。當在流體系統中的底物分子流經芯片表面時,發生分子之間的相互作用,熒光素分子釋放熒光,發生熒光信號的改變,以此表征分子結合的動力學參數。
根據熒光信號改變的不同原理,我們可以在芯片表面進行不同的檢測模式的設計。對于雙特異性抗體來說,我們采用的是 “Y” 型結構的DNA納米桿,其原理示意圖如Figure 2所示:
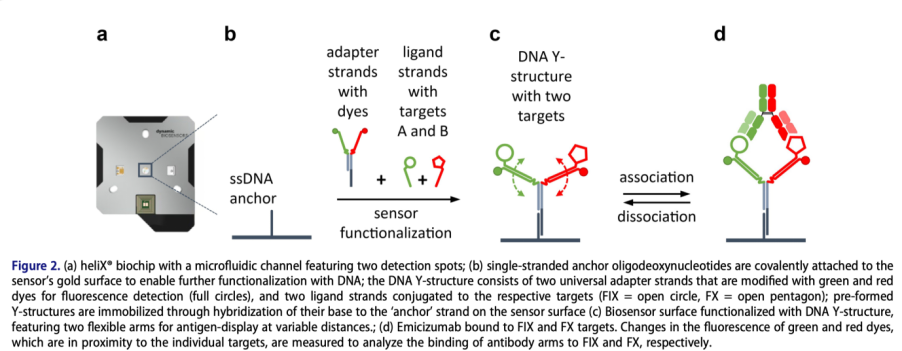
該 “Y” 型結構的兩個臂中,兩條適配鏈分別帶有紅色和綠色兩種熒光,兩條配體鏈分別攜帶有待檢測的兩種抗原。在Emicizumab的流體動力學研究中,分別是凝血因子FIX和FX。該設計突破了單個參數進行三元復合物檢測的局限,采用雙色熒光分別對每一個二元復合物進行檢測,同時,利用熒光分子與環境互作的敏感性光學原理,檢測三元復合物形成的狀態。
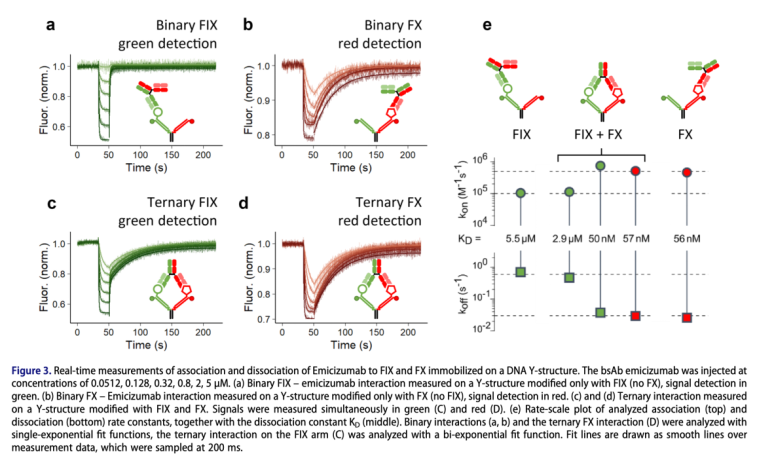
如Figure 3所示,在Emicizumab與抗原結合的動力學研究設計中,一組設計為兩條配體鏈分別攜帶兩種待檢測抗原(Figure c和d),一組設計為配體鏈攜帶其中一種抗原,其中的另外一條配體鏈不與配體進行結合(Figure a和b)。其中綠色熒光端配體鏈結合的是凝血因子FIX,紅色熒光端配體鏈結合的是FX。在進行三元復合物檢測時,當底物分子(Emicizumab)與FIX和FX結合形成三元復合物時,綠色和紅色兩種熒光分子由于配體(抗體)的結合,其存在的環境發生改變,兩種熒光分子與環境的互作導致其發生熒光的淬滅。
與二元復合物的結合動力學相比,可以看出,FIX的存在,對FX與抗體結合的親和性具有明顯的影響(Figure 3)。該技術不僅可以直觀的反饋雙抗原彼此之間的相互影響,通過解離曲線,我們也可以觀測到,在三元復合物的解離過程中,存在雙相的解離形式,表現為該抗體與抗原的解離存在快和慢兩種解離過程。
在雙特異性抗體的研發中,對藥物與靶分子的解離速度的要求或親和性的需求,根據藥物實現的功能不同而有所差異。為了更進一步闡明雙特異性抗體的濃度變化如何影響三元復合物的不同解離過程,我們采用了濃度梯度檢測。
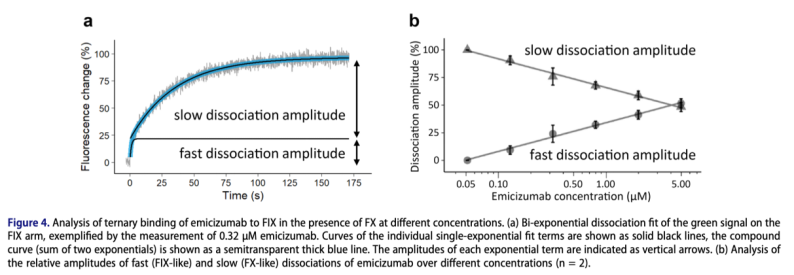
如Figure 4所示,隨著Emicizumab濃度的增加,慢解離過程所占的比例逐漸增加。這說明,濃度提高,FIX與抗體結合的動力學影響程度提高;而在低濃度時,FX與抗體結合的動力學影響程度提高。這對于指導后續臨床類藥物的開發具有極大的意義。而傳統的二元復合物檢測技術,無法實現該參數的測量與數據的擬合。
Switchsense是基于生物芯片發展起來的一門技術,由位于德國慕尼黑DBS(Dynamic Biosensor)公司研發,其儀器稱為Helix Plus多模式分子互作儀器,目前該公司已被布魯克(BRUKER)收購,HelixPlus也將成為其分子互作領域的重磅產品。儀器外觀如圖所示:

該儀器可以進行多種類型的分子互作檢測,包括二元互作,比如蛋白和蛋白,蛋白和核酸,小分子和蛋白等;三元復合物檢測,比如文中提到的雙特異性抗體(Bispecific Antibody)以及PROTAC分子等;除互作之外,該儀器可以檢測小分子或核酸等誘導的蛋白構象的變化,對于當今的藥物研發領域來說,無疑是具有重要意義的檢測手段。
蛋白構象變化檢測原理圖




