在生物醫(yī)學(xué)領(lǐng)域,藥物研發(fā)始終是一場與時(shí)間賽跑、與病魔較量的艱苦征程。近年來,新藥研發(fā)的步伐逐漸放緩,從1991-2000年21個(gè)主要國家發(fā)現(xiàn)367種新藥,到2001-2010年降至251種,進(jìn)入臨床試驗(yàn)的新藥數(shù)量也越來越少,研發(fā)周期越來越長[1,2]。這背后的原因復(fù)雜多樣,其中藥物研發(fā)過程中化學(xué)合成與生物篩選環(huán)節(jié)的分離和不兼容,成為了阻礙新藥研發(fā)的關(guān)鍵因素。傳統(tǒng)的有機(jī)合成方法不僅耗時(shí)耗力,且合成過程中大量使用的有機(jī)溶劑和嚴(yán)苛條件,與生物篩選所需的溫和水性環(huán)境及小型化、平行化要求格格不入。不過,一項(xiàng)名為chemBIOS的創(chuàng)新技術(shù)平臺(tái)的出現(xiàn),為這一困境帶來了轉(zhuǎn)機(jī)。
chemBIOS平臺(tái)與合成所需的有機(jī)溶劑和生物篩選所需的水溶液相容。我們使用chemBIOS平臺(tái)進(jìn)行75個(gè)平行的三組分反應(yīng)來合成一個(gè)脂質(zhì)體庫,然后通過MALDI-MS進(jìn)行表征,在芯片上形成lipoplexes,并在芯片上進(jìn)行細(xì)胞篩選。從文庫合成到細(xì)胞篩選的整個(gè)過程僅需3天,總?cè)芤毫考s為1mL,證明了chemBIOS技術(shù)在提高效率、加速篩選和藥物開發(fā)方面的潛力。
LSTL玻片:通過硅烷化處理和光化學(xué)硫醇-烯點(diǎn)擊反應(yīng),在玻璃表面形成親疏兩性圖案(圖1a)。親水性區(qū)域可穩(wěn)定低表面張力有機(jī)溶劑(如DMSO),疏水性邊界則通過全氟癸硫醇(PFDT)修飾,實(shí)現(xiàn)微滴陣列的精準(zhǔn)控制。
HSTL玻片:涂覆多孔聚(甲基丙烯酸羥乙酯-共-二甲基丙烯酸乙二醇酯)聚合物層,結(jié)合光化學(xué)硫醇-炔點(diǎn)擊反應(yīng),形成親水性斑點(diǎn)(接觸角<10°)與超疏水性邊界(接觸角>150°),適用于高表面張力水溶液(如水、脂質(zhì)體)的微滴陣列(圖1b)。
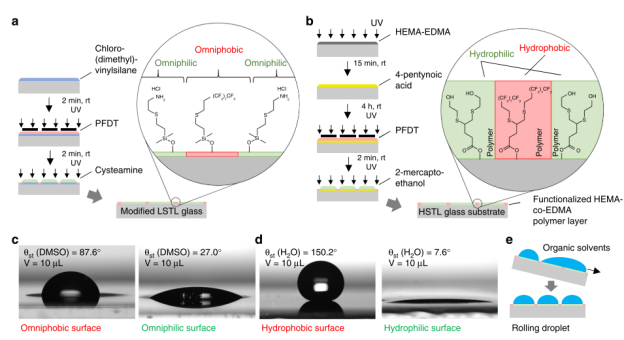
圖1. 用于chemBIOS平臺(tái)的圖案化載玻片的制造和表征。chemBIOS平臺(tái)由兩種類型的圖案化載玻片組成。a.與低表面張力液體相容的載玻片(LSTL載玻片)是通過使用氯(二甲基)乙烯基硅烷對(duì)玻璃表面進(jìn)行硅烷化,并通過光化學(xué)硫醇-烯點(diǎn)擊反應(yīng)形成圖案而制備的。通過與全氟癸硫醇(PFDT)反應(yīng)生成全疏邊界,然后通過半胱胺鹽酸鹽形成全嗜斑點(diǎn)。斑點(diǎn)直徑2.83mm;疏水邊界寬度1.67mm。b.用于高表面張力液體的載玻片(HSTL載玻片)通過聚合反應(yīng)來制造,以施加聚(2-羥乙基甲基丙烯酸酯-共-乙烯二甲基丙烯酸酯)的多孔聚合物層。用4-戊炔酸的官能化使得能夠通過硫醇炔光點(diǎn)擊化學(xué)進(jìn)一步形成表面圖案。通過PFDT生成疏水邊界,然后使用2-巰基乙醇形成親水斑點(diǎn)。斑點(diǎn)直徑2.83mm;疏水邊界寬度1.67mm。c. DMSO液滴在用于具有相應(yīng)靜態(tài)接觸角的LSTL圖案的全疏表面和全親水表面上的照片。液滴體積:10 μL。d. 用于HSTL載玻片的疏水和親水表面上水滴的照片,具有相應(yīng)的靜態(tài)接觸角。液滴體積:10 μL。e. 示意圖顯示了圖案化LSTL載玻片上的不連續(xù)去濕效果,這使得能夠手動(dòng)生成有機(jī)液滴陣列
I.DOT精準(zhǔn)分配:利用I.DOT非接觸式移液系統(tǒng)(死體積 <1 μL),將胺類溶液(A1-A5)與硫代內(nèi)酯/吡啶基二硫化物混合物分別以列、行方式精準(zhǔn)分配至LSTL玻片(圖2a)。75個(gè)微反應(yīng)器同步反應(yīng)2小時(shí),產(chǎn)率達(dá)89±15%。
產(chǎn)物表征:通過MALDI-TOF質(zhì)譜(圖2c)驗(yàn)證結(jié)構(gòu),片上液-液萃取技術(shù)(圖3)分離親水/疏水染料(亞甲藍(lán)純度91%,尼羅紅57%)。
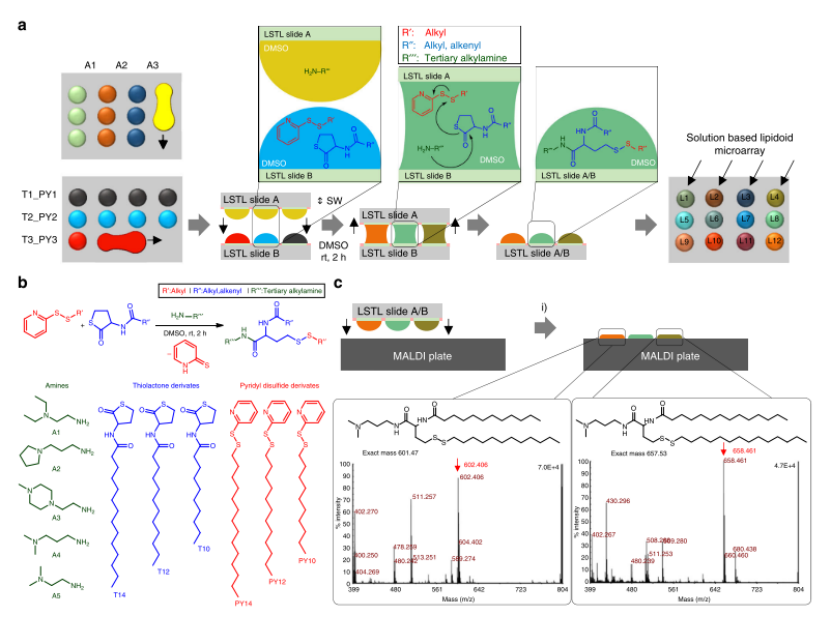
圖2. 一個(gè)脂質(zhì)體庫的片上合成和表征。a. 使用chemBIOS平臺(tái)組合合成脂質(zhì)體的示意圖。在第一步中,將溶解在DMSO中的各種胺逐柱施加到低表面張力液體(LSTL)載玻片A上。然后,將溶于DMSO的硫內(nèi)酯和吡啶基二硫化物衍生物的混合物以與載玻片A上的列正交的行施加到LSTL載玻片B上。通過滾動(dòng)溶液液滴以形成成排的單獨(dú)液滴來進(jìn)行施加。在下一步驟中,將載玻片A和載玻片B彼此夾在中間(SW)以使各個(gè)液滴接觸以合并液滴,從而引發(fā)反應(yīng)。在室溫下2小時(shí)后完成反應(yīng)。在單個(gè)載玻片上一式三份合成每個(gè)載玻片25種不同的脂質(zhì)體。b. 反應(yīng)方案和反應(yīng)的所有不同前體的列表。c. 為了表征所產(chǎn)生的化合物,將載玻片A夾在MALDI板上,然后加入基質(zhì)并干燥板。MALDI-TOF質(zhì)譜測(cè)量(插圖中所示的光譜實(shí)例,正模式)使得能夠快速且方便地表征合成化合物的整個(gè)庫。(i)靜置,然后加入含有0.1%v/v三氟乙酸的1:1乙腈:水的10 mg·mL?1 α-氰基-4-羥基肉桂酸溶液。源數(shù)據(jù)作為源數(shù)據(jù)文件提供。
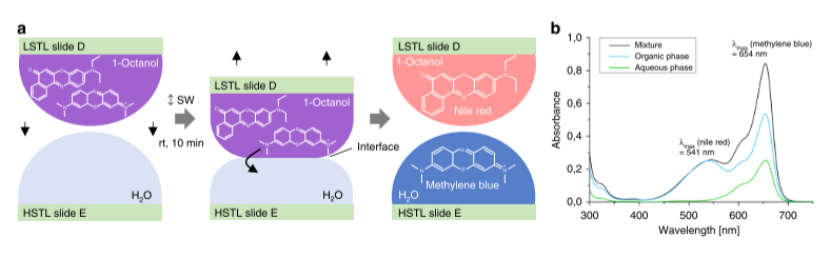
圖3. 片上平行液-液萃取。a芯片上兩相液體萃取過程的示意圖。親油尼羅紅和親水性亞甲基藍(lán)在1-辛醇的LSTL載玻片D上的混合物,通過將載玻片與HSTL載玻片E進(jìn)行10分鐘的水滴分離。兩種不混溶的溶劑之間形成界面,并將水溶性亞甲基藍(lán)提取到水相中。B通過紫外-可見光譜法驗(yàn)證芯片上提取。混合物的UV-Vis光譜顯示兩個(gè)局部吸收最大值:一個(gè)在541 nm處對(duì)應(yīng)于尼羅紅,另一個(gè)在654 nm處對(duì)應(yīng)于亞甲基藍(lán)。萃取后,有機(jī)相中亞甲基藍(lán)的最大吸收強(qiáng)度降低,而尼羅紅的最大吸收強(qiáng)度保持不變。在水相中,沒有檢測(cè)到尼羅紅。源數(shù)據(jù)作為源數(shù)據(jù)文件提供。
自動(dòng)化轉(zhuǎn)移:I.DOT將干燥的脂質(zhì)體轉(zhuǎn)移至HSTL玻片(圖4a),與含質(zhì)粒DNA(pCS2-GFP)的醋酸鈉緩沖液共孵育,形成脂質(zhì)復(fù)合物(lipoplexes)。動(dòng)態(tài)光散射顯示,lipoplexes粒徑(515±34 nm)顯著大于脂質(zhì)體(376±122 nm),zeta電位更低(-16mVvs+27mV,圖4b)
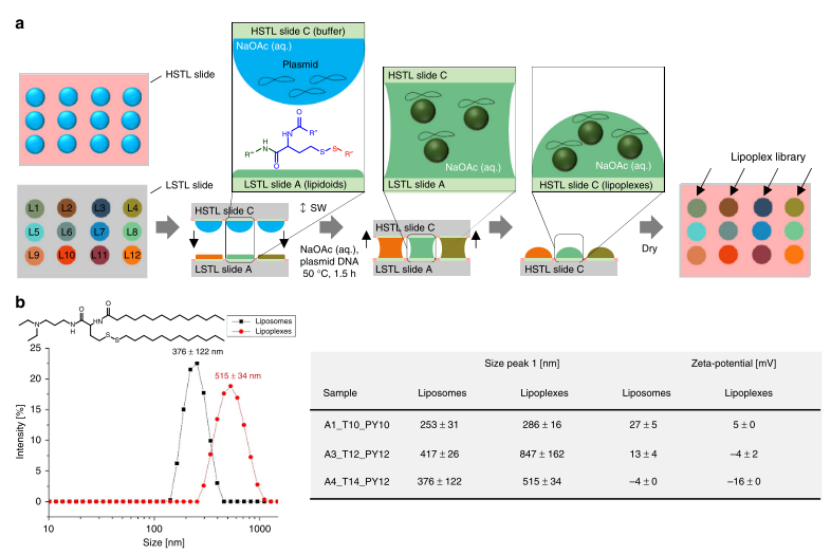
圖4. 脂質(zhì)體或脂質(zhì)復(fù)合物文庫的芯片上平行形成。a脂質(zhì)復(fù)合物形成的示意圖。將含有蔗糖、明膠、纖連蛋白和pDNA(pCS2-GFP)的水性乙酸鈉緩沖液滴的陣列(HSTL載玻片C)與含有干燥的脂質(zhì)體文庫的LSTL載玻片A夾在一起,然后在50°C下孵育1.5小時(shí)并干燥,然后將載玻片C用于以下反向細(xì)胞轉(zhuǎn)染實(shí)驗(yàn)。以相同的方式產(chǎn)生脂質(zhì)體,而不添加質(zhì)粒DNA。B脂質(zhì)復(fù)合物和相應(yīng)脂質(zhì)體的動(dòng)態(tài)光散射(DLS)和ζ電位分析的結(jié)果。脂質(zhì)體顯示出比相應(yīng)的脂質(zhì)復(fù)合物更小的顆粒和更高的ζ電位。?值為標(biāo)準(zhǔn)偏差,n=3(重復(fù)次數(shù))。源數(shù)據(jù)作為源數(shù)據(jù)文件提供
細(xì)胞打印與分析:通過I.DOT將HEK293T細(xì)胞懸液(6×10?cells/mL)精準(zhǔn)打印至lipoplexes陣列(圖5a),48小時(shí)后通過Hoechst/PI染色和熒光顯微鏡分析轉(zhuǎn)染效率。最優(yōu)脂質(zhì)體A3_T14_PY14實(shí)現(xiàn)52±4%轉(zhuǎn)染效率(圖5b),優(yōu)于商業(yè)化試劑ScreenFect A(34%)。
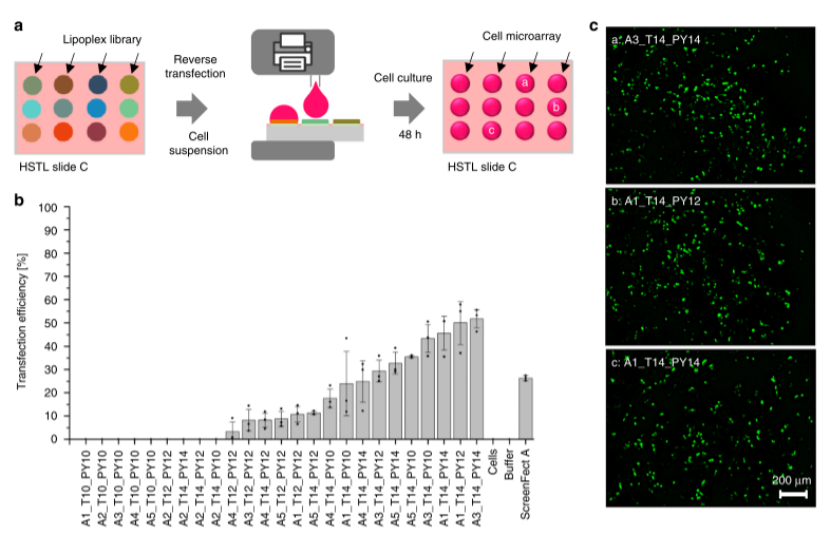
圖5. 所產(chǎn)生的lipoplex文庫的芯片上反向細(xì)胞轉(zhuǎn)染篩選。a顯示芯片上細(xì)胞轉(zhuǎn)染篩選過程的示意圖。將5微升的HEK 293 T細(xì)胞懸浮液印刷到HSTL載玻片C上的每個(gè)親水性斑點(diǎn)中,所述HSTL載玻片C被干燥的lipoplex細(xì)胞轉(zhuǎn)染混合物覆蓋。在36 °C和5%C02下孵育陣列48小時(shí)后,將1 μL染色溶液打印到每個(gè)液滴中,然后孵育15分鐘并進(jìn)行熒光顯微鏡分析。B可視化轉(zhuǎn)染效率(GFP轉(zhuǎn)染細(xì)胞數(shù)/總細(xì)胞數(shù))平均值的條形圖,其基于覆蓋整個(gè)管道的三個(gè)獨(dú)立實(shí)驗(yàn)(重疊的點(diǎn)圖)計(jì)算,包括芯片上文庫合成、脂質(zhì)復(fù)合物的形成和細(xì)胞轉(zhuǎn)染。在我們的研究中,A3_T14_PY14脂質(zhì)體被證明是最有效的,導(dǎo)致52 ± 4%的轉(zhuǎn)染效率。誤差條是標(biāo)準(zhǔn)偏差,n=3(重復(fù)次數(shù)); N=3(重復(fù)次數(shù),包括脂質(zhì)合成)。源數(shù)據(jù)以源數(shù)據(jù)文件的形式提供。c pCS 2-GFP轉(zhuǎn)染細(xì)胞的熒光顯微鏡圖像。比例尺:200 μm
chemBIOS平臺(tái)通過“芯片級(jí)化學(xué)-生物聯(lián)姻”首次實(shí)現(xiàn)了溶液相有機(jī)合成與高通量生物篩選的無縫銜接,其核心驅(qū)動(dòng)力I.DOT非接觸式移液技術(shù)具備三大優(yōu)勢(shì):一是精準(zhǔn)操控,通過納升級(jí)液體分配確保反應(yīng)一致性并降低交叉污染風(fēng)險(xiǎn);二是高通量整合,支持多步自動(dòng)化操作(如細(xì)胞打印、試劑添加)以加速藥物篩選流程;三是兼容性擴(kuò)展,未來可結(jié)合I.DOT的液滴融合技術(shù)(如proMAD方法)構(gòu)建更復(fù)雜的3D細(xì)胞模型(如腫瘤球體),進(jìn)一步拓展個(gè)性化醫(yī)療應(yīng)用潛力。
盡管chemBIOS展現(xiàn)了巨大潛力,但高溫反應(yīng)、固相試劑添加及高通量純化仍是待解決的難題。通過I.DOT的智能化升級(jí)(如動(dòng)態(tài)液滴監(jiān)測(cè)),可進(jìn)一步提升平臺(tái)的靈活性與普適性。未來,結(jié)合微流控技術(shù)與自動(dòng)化系統(tǒng),該平臺(tái)有望推動(dòng)“按需合成-實(shí)時(shí)篩選”的精準(zhǔn)藥物研發(fā)模式,為個(gè)性化醫(yī)療和罕見病藥物開發(fā)提供革命性工具。

同騰睿杰(上海)生物技有限公司作為CYTENA I.DOT中國總代理商,為您提供優(yōu)質(zhì)的售前售后服務(wù)。
聯(lián)系電話:021-50826962
聯(lián)系郵箱:sales@ttbiotech.com




