在大腦這一復雜的器官中,神經膠質細胞扮演著至關重要的角色。包括星形膠質細胞、少突膠質細胞和小膠質細胞在內的神經膠質細胞,這些細胞不僅參與調節大腦的穩態功能、髓鞘形成及神經信號傳遞,還在神經損傷的響應中發揮了重要作用[1]。這些細胞功能的任何失調,都可能與發育性和神經退行性疾病的發病機制有關[2]。在大腦樣本中,小膠質細胞通常僅占目標群體的10%不到,少突膠質細胞則約占目標群體的20%以上,而星形膠質細胞可占目標群體的17%至61%[3,4]。細胞分選可以幫助這些神經膠質研究,并加強從不同細胞群中純化單個細胞類型,正如在大腦中發現的那樣。
WOLF G2®Cell Sorter:精準捕捉神經膠質細胞
NanoCellect Biomedical, Inc. 推出的WOLF G2®Cell Sorter,為研究者提供了一種從新鮮和固定的小鼠腦組織中分離這些關鍵神經膠質細胞的高效方法。該技術的應用,不僅提高了樣本處理的靈活性,還保證了細胞的高純度和活性。本應用中采用鋅固定法用于處理無法即時使用的腦組織,該方法可以有效的保持細胞結構和RNA的完整性[5,6]。
在將成年小鼠腦(C57BL/6, Crown Biosciences)放置在裝有EBSS的冰盤中切割成小塊,離心后去除上清液。隨后加入含有HBSS、FBS、HEPES、Dispase II和DNase I的酶混合物中,37°C水浴中酶解。每5分鐘攪拌20次避免組織粘附損失,15分鐘后使用不同大小的槍頭進行3次慢速抽打混勻。隨后通過70 μm尼龍網過濾,并使用無鈣和鎂的HBSS、1% BSA和2 mM EDTA組成的低溫分選緩沖液洗滌3次,離心5分鐘。
用1 mL含鎂和鈣的10×HBSS稀釋9 mL Percoll Plus制備等滲Percoll,然后用1×不含鈣和鎂的HBSS進一步稀釋該等滲溶液,形成30% Percoll溶液。使用RBC緩沖液去除紅細胞后,采用30% Percoll溶液進行重懸,離心后去除髓鞘。多余的分選緩沖液重懸顆粒離心后用低溫分選緩沖液重懸樣品進行細胞染色。
將快速冷凍的成年小鼠腦(Rockland, MS-T004)于1×鋅緩沖液中4°C處理過夜。次日離心并洗滌后于冰上切碎,使用槍頭抽打分散,然后通過70 μm網過濾,洗滌。用分選緩沖液重懸樣品進行細胞染色。
新鮮細胞樣本使用ASCA-2 PE、O4 APC和CD11b APC進行染色;固定細胞樣本僅使用ASCA-2 PE染色,新鮮細胞和固定細胞在4°C黑暗中孵育30分鐘,然后洗滌。洗滌后將樣品稀釋至終濃度為3.0×105個細胞/mL,在分析前通過40 μm細胞過濾器過濾兩次,并在分選前使用DAPI進行活細胞染色。
使用WOLF G2®Cell Sorter,通過儀器紅色激光配置(488/637 nm)及紫色激光配置(405/488 nm)分別對不同標記的細胞進行分選。此外,用7-AAD染色樣品,在分選2小時后測量新鮮小鼠組織中星形膠質細胞分選后活力,并與預分選樣品和由25%熱滅活細胞及75%活細胞組成的對照樣品進行比較。
1、在分選前,新鮮小鼠腦中星形膠質細胞的起始目標群為25.8%,小膠質細胞為15.6%,少突膠質細胞為40.7%。新鮮小鼠腦中分離的星形膠質細胞、小膠質細胞和少突膠質細胞分選后純度分別達到了92.7%、95.7%和93.2%。固定小鼠腦組織中的星形膠質細胞經過分選后,純度從58.2%富集到81.5%。
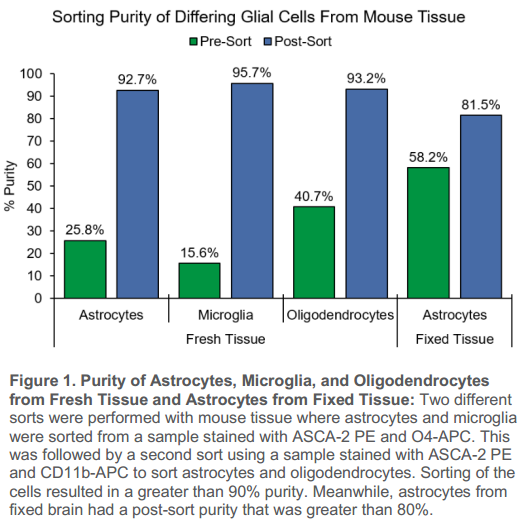
圖1. 新鮮組織中星形膠質細胞、小膠質細胞、少突膠質細胞和固定組織中星形膠質細胞的純度:對小鼠組織進行兩種不同的分選,其中從ASCA-2 PE和O4-APC染色的樣品中分選星形膠質細胞和小膠質細胞。隨后用ASCA-2 PE和CD11b-APC染色的樣品進行第二次分類,對星形膠質細胞和少突膠質細胞進行分類。細胞分選后純度大于90%。同時,固定腦組織的星形膠質細胞分選后純度大于80%。
2、分選前,固定的腦組織樣本在分選前可以觀察到大量星形膠質細胞碎片(圖2A);分選后,碎片顯著減少,留下的是大部分純化的星形膠質細胞(圖2B)。
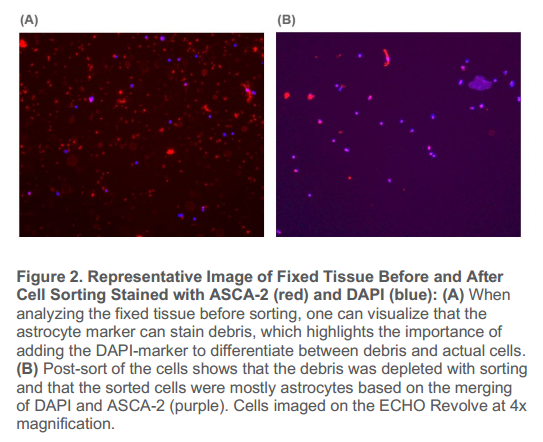
圖2. 用ASCA-2(紅色)和DAPI(藍色)染色細胞分選前后固定組織代表圖:(A)在分選前對固定組織進行分析時,可觀察到星形膠質細胞標記物能夠染色碎片,這突出了添加DPAI-maker區分碎片和實際細胞的重要性。(B)細胞后分選顯示碎片被分選耗盡,根據DAPI和ASCA-2的合并,分選的細胞以星形膠質細胞為主(紫色)。細胞在ECHO Revolve 上以4倍放大率成像。
3、與預分選樣本相比,新鮮腦組織中分離的星形膠質細胞經分選后的活率保持不變,超過90%的細胞仍然存活。預分選細胞活率為92.5%,分選后提高到98.9%。活/死對照混合物的細胞活率為73.6%,這表明溫和的分選過程有利于維持細胞活率。
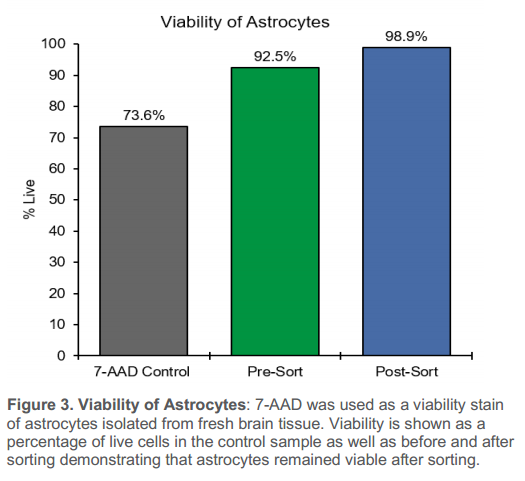
圖3. 星形膠質細胞的活率:7-AAD 被用作從新鮮腦組織中分離出的星形膠質細胞的活性染色劑。活性為對照樣本以及分選前后活細胞的百分比,表明星形膠質細胞在分選后仍具有活性。

WOLF G2®Cell Sorter的應用,為神經科學研究提供了一個強大的工具,使得研究者能夠從復雜的腦組織中高效地分離出目標細胞群體。無論是新鮮還是固定的樣本,該技術都能夠保證細胞的高純度和活率從而獲得更廣泛的組織可用性,可為下游實驗如單細胞測序等提供可靠的細胞來源。
[1] AstrDomingues HS, Portugal CC, Socodato R and Relvas JB (2016) Oligodendrocyte, ocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Front. Cell Dev. Biol. 4:71. doi: 10.3389/fcell.2016.00071.
[2] Agalave NM, Lane BT, Mody PH, Szabo-Pardi TA, and Burton MD (2020) Isolation, culture, and downstream characterization of primary microglia and astrocytes from adult rodent brain and spinal cord. Journal of Neuroscience Methods. 340: 108742. https://doi.org/10.1016/j.jneumeth.2020.108742.
[3] Valério-Gomes B, Guimar?es DM, Szczupak D, Lent R. The Absolute Number of Oligodendrocytes in the Adult Mouse Brain. Front Neuroanat.2018 Oct 30;12:90. doi: 10.3389/fnana.2018.00090
[4] Garland EF, Hartnell IJ and Boche D (2022) Microglia and Astrocyte Function and Communication: What Do We Know in Humans? Front. Neurosci. 16:824888. doi: 10.3389/fnins.2022.824888
[5] Martin D, Xu J, Porretta C, Nichols CD (2017). Neurocytometry: Flow cytometric sorting of specific neuronal populations from human and rodent brain. ACS Chem Neurosci. 8(2): 356–367. doi:10.1021/acschemneuro.6b00374.
[6] Abshair M, Adams D, Bergeron A, Brundage K, Clise-Dwyer K, Cochran M, Del Rio Guerra R, Holmes L, Lood N, Meyer M, Niziolek Z, Saluk A, and Thornton S (2019). A Multi-Core Study on How Different Fixation Methods Prior to Sorting Impact the Purity, Quality, and Yield of RNA From Sorted Cells. Poster presented at: ABRF 2019 – The Association of Biomolecular Resource Facilities; April 23, 2019; San Antonio, TX.
同騰睿杰(上海)生物科技有限公司作為Nanocellect中國南區總代理商,為您提供優質的售前售后服務。
聯系電話:021-50826962
聯系郵箱:sales@ttbiotech.com




